В ходе изучения химии в 9 классе, одной из важных тем является изучение свойств и химических реакций металлов. Экспериментальные задачи по данной теме позволяют учащимся лучше понять особенности поведения металлов и применить полученные знания на практике.
Одной из задач может быть определение активности металлов по их реакции с различными растворами. Для этого учащимся предлагается провести серию экспериментов, во время которых они смешивают растворы различных металлов с растворами солей других металлов. По результатам реакций можно сделать выводы о степени активности металлов и их способности вытеснять другие металлы из растворов ионов.
Другой интересной задачей является проведение экспериментов на определение стойкости окислительных свойств металлов. Учащиеся могут провести ряд реакций, в результате которых будут образовываться окислители и восстановители на основе различных металлов. По результатам экспериментов можно выяснить, какие металлы оказывают наиболее сильное окислительное или восстановительное действие. Также можно исследовать зависимость степени окисления металлов от pH-среды.
Таким образом, проведение экспериментальных задач по теме металлы позволяет учащимся углубить свои знания о свойствах и химических реакциях металлов, развить навыки практической работы и анализа полученных результатов. Это помогает более полно и осмысленно воспринимать учебный материал и применять его в реальной жизни.
Экспериментальные задачи по теме "Металлы" для практической работы по химии 9 класс

1. Определение активности металлов
Для проведения данного эксперимента необходимо подготовить серию пробок из разных металлов (например, цинк, железо, медь, алюминий) и насытить каждую раствором соли металла, например, хлоридом цинка, хлоридом железа и т.д. Затем поместить каждую пробку в отдельную пробирку с раствором соли и наблюдать изменения: появление пленки активного металла на поверхности раствора, оседание металла на дне пробирки или отсутствие реакции. Сделать выводы о активности металлов по их реакционной способности.
2. Взаимодействие металлов с кислотами
Для данного эксперимента необходимо подготовить серию пробирок с растворами различных кислот (например, соляной кислоты, уксусной кислоты, серной кислоты) и добавить в каждый раствор кусочек разного металла (например, цинка, железа, меди, алюминия). Наблюдать реакции, происходящие в каждой пробирке: выделение газов, изменение цвета раствора, образование осадка. Сделать выводы о взаимодействии металлов с кислотами и их активности.
3. Сравнение активности металлов
Для проведения данного эксперимента необходимо подготовить серию пробирок с растворами разных металлов и разместить их в ряд. Затем добавить в каждый раствор одинаковое количество стандартного вещества (например, серы) и наблюдать за скоростью его растворения в каждой пробирке. Сделать выводы о сравнительной активности металлов.
4. Электролитическое осаждение металлов
Для данного эксперимента необходимо подготовить установку для электролиза, состоящую из источника постоянного напряжения, двух электродов (анода и катода) и раствора соли одного из металлов. Подключить электроды к источнику напряжения и наблюдать за процессом осаждения металла на катоде. Изучить зависимость скорости осаждения от приложенного напряжения и сделать выводы о различной реакционной способности металлов.
5. Окисление металлов в воздухе
Для проведения данного эксперимента необходимо взять несколько полосок разных металлов (например, железа, меди, алюминия) и оставить их на воздухе в течение некоторого времени. Наблюдать за изменением цвета и состоянием поверхности металлов. Сделать выводы о скорости окисления металлов и их стойкости к воздействию кислорода.
Определение реактивности металлов
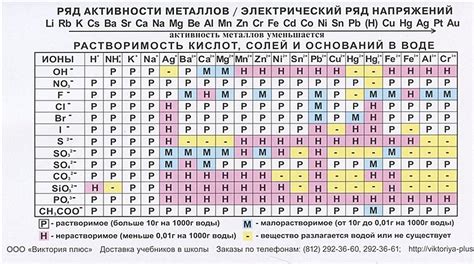
Реактивность металлов - это способность металла реагировать с различными веществами, образуя новые соединения. Определение реактивности металлов важно для понимания их химических свойств и возможности использования в различных процессах.
Экспериментальное определение реактивности металлов можно провести с помощью реакции с кислотами. Для этого необходимо приготовить растворы различных кислот и провести их взаимодействие с разными металлическими образцами.
Для проведения опыта следует использовать различные металлы, такие как железо, цинк, медь, алюминий и другие. Каждый металл должен быть представлен в виде образца определенного размера и формы.
При проведении эксперимента следует использовать специальную аппаратуру, например, пробирку или пипетку для измерения объемов реактивов. Необходимо также вести наблюдение за ходом реакции и записывать результаты.
Результаты опыта позволят определить, какой металл реагирует с кислотой более интенсивно, выделяет больше газов или проявляет другие признаки реактивности. Полученные данные можно представить в виде таблицы или графика для удобства анализа и сравнения.
Зная реактивность металлов, можно прогнозировать их поведение в различных химических реакциях и выбирать подходящий металл для выполнения конкретных задач и производства различных изделий.
Измерение осадка, образующегося при взаимодействии металлов и кислот

Для изучения взаимодействия металлов и кислот на практическом уровне можно провести эксперимент, направленный на измерение осадка, образующегося при этом процессе. Этот эксперимент позволяет наглядно продемонстрировать химическую реакцию между металлом и кислотой и определить количество образовавшегося осадка.
Для проведения эксперимента понадобятся металлические полоски (например, цинк или железо), различные кислоты (например, серная или соляная) и растворитель (например, вода). Начинать следует с подготовки растворов кислоты в нужной концентрации, а затем металлических полосок достаточно размера для погружения в опытную посуду. Полоски погружаются в растворы кислоты и в течение определенного времени ведется наблюдение за образованием осадка.
Основной этап эксперимента заключается в измерении массы осадка. Для этого необходимо аккуратно удалить полоски из раствора и промыть их водой, чтобы удалить остатки кислоты. Затем осадок с полоски собирают в специальную чашку и помещают в сушильный шкаф для полного высыхания. После этого осадок взвешивают на тарированных весах и регистрируют массу.
Полученная масса осадка позволяет судить о количестве металла, реагировавшего с кислотой. Чем больше масса осадка, тем больше металла вступило в реакцию. В результате эксперимента можно сравнить реакционную активность различных металлов и кислот и сделать выводы о их химических свойствах.
Исследование растворимости металлов в различных кислотах и щелочах
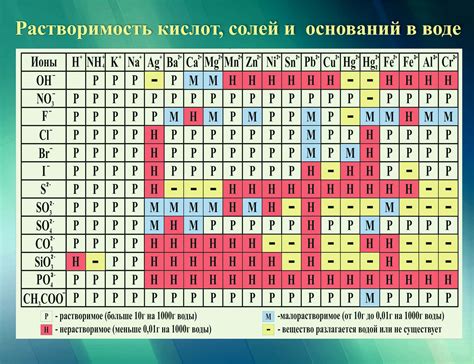
Экспериментальное исследование растворимости металлов в различных кислотах и щелочах является важной частью практической работы по химии 9 класса. Это позволяет учащимся изучить свойства различных металлов и их взаимодействие с кислотами и щелочами.
В ходе эксперимента учащиеся подготавливают растворы кислот и щелочей различной концентрации. Затем они добавляют в каждый раствор небольшую порцию металла и наблюдают реакцию. В результате реакции могут образоваться различные продукты: соли металла, газы или осадки.
Для проведения исследования используются различные металлы, такие как цинк, железо, медь, свинец и др. Каждый металл имеет свои особенности взаимодействия с кислотами и щелочами. Например, цинк активно реагирует с соляной кислотой, образуя соль и выделяя водород. Медь же реагирует с серной кислотой, образуя соль и оксиды серы.
Эксперимент позволяет учащимся увидеть, как меняется растворимость металлов в зависимости от их химических свойств. Также ученики могут сравнить скорость реакции разных металлов с различными кислотами и щелочами. Это позволяет им лучше понять причины разности в активности металлов и использовать полученные знания в дальнейшем изучении химии.
Определение активности металлов по их взаимодействию с соляной кислотой

Одним из способов определения активности металлов является их взаимодействие с соляной кислотой. Этот эксперимент позволяет выявить, насколько активными являются различные металлы, и установить их относительную активность.
Для проведения эксперимента необходимо приготовить раствор соляной кислоты определенной концентрации. Затем к этому раствору добавляют по очереди разные металлические образцы и наблюдают за происходящей реакцией.
Если металл активен, то при его контакте с соляной кислотой происходит бурное выделение газа и образование соли металла. В случае неактивного металла реакция будет протекать медленно или отсутствовать вообще.
Для записи полученных результатов удобно использовать таблицу, в которой указываются названия металлов и характер их взаимодействия с кислотой. Важно помнить, что при проведении такого эксперимента необходимо соблюдать меры безопасности, так как реакция с соляной кислотой может сопровождаться выделением едкого газа и образованием токсичных парами.
Определение активности металлов по их реакции с медным купоросом

Активность металлов - это способность металла вступать в химические реакции с другими веществами. Она зависит от электрохимических свойств металла и его положения в ряду активностей металлов.
Одним из способов определения активности металлов является их реакция с раствором медного купороса (CuSO4). При этом происходит обмен атомов меди и металла, что приводит к осаждению меди на поверхности металла.
Чтобы провести опыты, необходимо подготовить раствор медного купороса различной концентрации. Затем металлические полоски разного металла погружаются в растворы и наблюдаются изменения.
Металлы, обладающие большей активностью, вытесняют медь из раствора и на их поверхности образуется осадок меди. Металлы, обладающие меньшей активностью, не реагируют с медным купоросом и не образуют осадок.
На основе результатов опытов можно построить ряд активностей металлов, который отражает их относительную активность. Такой ряд позволяет сравнить активность различных металлов и использовать их в различных химических процессах.
Проверка изменения цвета растворов металлов при взаимодействии с растворителями различного характера
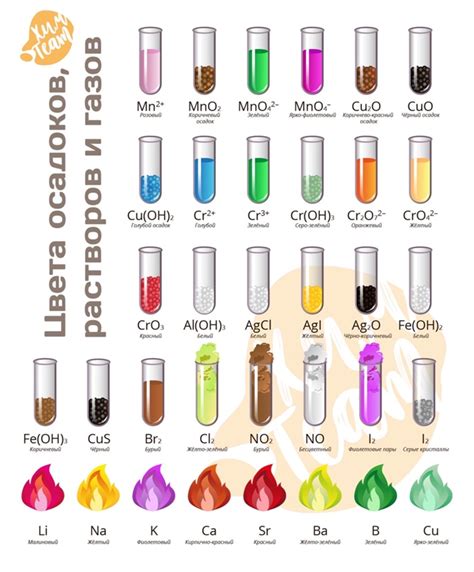
В рамках практической работы по химии 9 класс можно провести экспериментальную задачу, проверяющую изменение цвета растворов металлов при их взаимодействии с растворителями различного характера.
Для выполнения данной задачи потребуются растворы различных металлов, таких как железо, медь, цинк и алюминий. Также понадобятся растворители разного характера, например вода, соляная кислота, серная кислота и щелочи.
Прежде всего, необходимо подготовить растворы металлов, растворяя их в соответствующих растворителях. Затем можно приступить к наблюдению за изменением цвета растворов при взаимодействии с различными растворителями. Это может быть проиллюстрировано с помощью таблицы, в которой указывается название металла, его растворитель, а также изменение цвета раствора.
Например, при взаимодействии железа с водой, его раствор имеет зеленоватый цвет, а с соляной кислотой он становится желтоватым. Раствор меди с водой имеет голубой оттенок, а с серной кислотой - зеленый. Раствор цинка с водой ярко-синего цвета, а с щелочью - бесцветный. Алюминий образует безцветный раствор как с водой, так и со щелочью.
Таким образом, проведение данной экспериментальной задачи позволит учащимся наглядно увидеть изменение цвета растворов металлов при их взаимодействии с растворителями различного характера, что поможет закрепить знания о свойствах металлов и растворителей.
Исследование озоновывающего потенциала различных металлов
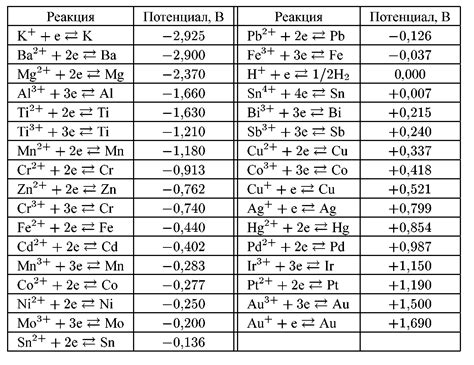
Одной из актуальных задач современной науки является исследование озоновывающего потенциала различных металлов.
Озон — это особый вид кислорода, обладающий высокой реакционной способностью. В атмосфере он играет важную роль в защите Земли от ультрафиолетового излучения Солнца. Однако определенные химические вещества, включая некоторые металлы, обладают способностью разрушать озоновый слой и тем самым приводить к серьезным экологическим проблемам. Поэтому важно изучить озоновывающий потенциал каждого металла, чтобы принять меры для предотвращения его негативного влияния на окружающую среду.
- Железо: исследования показали, что железо имеет низкий озоновывающий потенциал и, следовательно, оказывает минимальное воздействие на озоновый слой. Это свойство делает железо относительно безопасным для окружающей среды.
- Медь: научные исследования показывают, что медь обладает высоким озоновывающим потенциалом. Ее присутствие в атмосфере может негативно влиять на озоновый слой и приводить к деструкции молекул озона.
- Алюминий: данный металл обладает средним озоновывающим потенциалом. Он проявляет некоторую способность к разрушению озонового слоя, однако его воздействие не так сильно, как в случае с медью.
Таким образом, исследование озоновывающего потенциала различных металлов является важным направлением научной работы в области охраны окружающей среды. Результаты этих исследований позволяют принять меры для минимизации негативного влияния металлов на озоновый слой и сохранения экологического равновесия нашей планеты.
Вопрос-ответ

Какие экспериментальные задачи можно выполнить по теме металлы в химии для 9 класса?
Одной из задач может быть определение активности металлов с помощью вытеснения из растворов ионов других металлов. Например, можно провести эксперимент, в котором попытаться вытеснить медь из раствора ее соли, используя для этого цинк или железо.
Какие материалы и оборудование понадобятся для проведения экспериментов с металлами в химии для 9 класса?
Для выполнения экспериментов с металлами может понадобиться следующее оборудование: пробирки, штатив, пинцеты, пластмассовые или деревянные палочки, лабораторные весы. А также понадобятся химические реактивы (растворы солей металлов, кислоты) и металлы для проведения реакций (например, цинк, медь, железо).
Какие методы можно использовать для анализа полученных результатов экспериментов с металлами в химии для 9 класса?
Для анализа полученных результатов экспериментов с металлами можно использовать различные методы. Например, можно сравнить величину выделившегося газа при реакции металла с кислотой или раствором соли с массой использованного металла. Также можно провести визуальный анализ реакции, оценить скорость протекания реакции и т.д.
