Оксиды щелочных металлов являются важными и широко распространенными химическими соединениями. Они состоят из атомов металла и кислорода, и их основная функция заключается в реагировании с водой, кислотами, а также другими соединениями. Из множества оксидов, которые существуют в природе, особую научную и практическую значимость имеют высшие оксиды, так как они обладают наибольшей степенью окислительности и имеют самую сложную формулу.
Высший оксид щелочного металла, входящий в состав минералов и пород, имеет общую формулу MpOq, где M - символ металла (натрий, калий, литий и др.), p - число металлических атомов в молекуле, а q - число кислородных атомов. Количество металла и кислорода в природной форме может варьироваться в зависимости от источника и условий образования. Эти химические соединения обладают высокой химической активностью, что делает их полезными в различных отраслях промышленности и научных исследованиях.
Важно отметить, что формула высшего оксида щелочного металла не является постоянной и может зависеть от различных факторов, таких как условия синтеза, структура оксида, его тепловая устойчивость и другие. Также стоит учитывать, что оксиды щелочных металлов могут образовывать соединения с другими элементами и кислородом, что дополнительно усложняет определение их формулы.
Формула высшего оксида щелочного металла является важной информацией для химиков и исследователей, поскольку позволяет предварительно оценить его свойства и потенциальные применения. Кроме того, знание формулы оксидов помогает в разработке и создании новых материалов с определенными физико-химическими свойствами. Таким образом, изучение формул высших оксидов щелочных металлов является важным этапом в изучении и понимании свойств этих соединений.
Сущность и значение формулы высшего оксида щелочного металла

Формула высшего оксида щелочного металла представляет собой химическую запись соединения, в котором порядок окисления щелочного металла максимальный. Данный оксид имеет важное значение в химии щелочных металлов и используется в различных процессах и приложениях.
Оксиды щелочных металлов широко применяются в различных отраслях промышленности и жизни человека. Эти соединения используются в производстве стекла, керамики, щелочных батарей, а также в качестве катализаторов в химических реакциях.
Сущность формулы высшего оксида щелочного металла заключается в обозначении конкретного соединения и его химического состава. Формула позволяет идентифицировать соединение и определить его основные характеристики, такие как массовая доля элементов, строение и свойства.
Значение формулы высшего оксида щелочного металла заключается в том, что она позволяет химикам и исследователям более точно анализировать и описывать свойства и поведение данного соединения. Формула является основным инструментом для изучения оксидов щелочных металлов и открывает возможности для их применения в различных областях науки и техники.
Таким образом, формула высшего оксида щелочного металла имеет большое значение с точки зрения идентификации и описания химических соединений, а также для решения практических задач в различных областях науки и техники.
Определение и классификация щелочных металлов
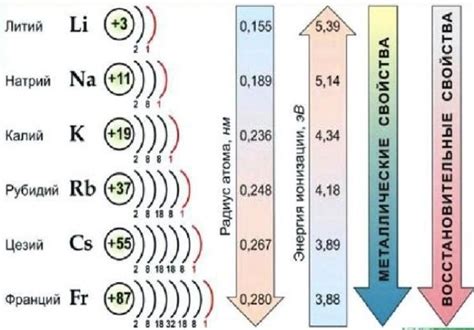
Щелочные металлы – это элементы первой группы (IА) периодической системы химических элементов. Всего в этой группе находятся шесть элементов: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к активным металлам и обладают низкой плотностью, низкой температурой плавления и высокой реактивностью с водой и кислородом.
Классификация щелочных металлов основана на химических и физических свойствах каждого элемента в этой группе. Все щелочные металлы обладают одной общей характеристикой – внешней электронной конфигурацией у них на валентной оболочке всего один электрон. Это делает их очень реактивными и способными образовывать соединения с различными элементами.
По атомным номерам щелочные металлы располагаются в порядке возрастания: литий - 3, натрий - 11, калий - 19, рубидий - 37, цезий - 55 и франций - 87. Химические свойства щелочных металлов становятся более выраженными по мере увеличения атомного номера. Один из наиболее известных и широко используемых примеров щелочных металлов - натрий, который широко применяется в пищевой промышленности и для очистки воды.
- Литий: наиболее низкая плотность, наименьшая реактивность, используется в аккумуляторах;
- Натрий: важный элемент для жизни, активно применяется в пищевой промышленности;
- Калий: необходимый элемент для растений и животных, используется в удобрениях;
- Рубидий: широко используется в научных исследованиях и в электронике;
- Цезий: применяется в различных научных исследованиях;
- Франций: самый редкий и радиоактивный элемент, не имеет практических применений.
Структура и свойства высших оксидов щелочных металлов

Высшие оксиды щелочных металлов представляют собой химические соединения, в состав которых входит кислород и щелочный металл. Они обладают разнообразными структурными и физическими свойствами, которые влияют на их реакционную способность и применение.
Структура высших оксидов щелочных металлов определяется их кристаллической решеткой. Например, оксид натрия (Na2O) имеет ионную структуру, где Na+ и О-2 ионы образуют трехмерную решетку. При этом атомы натрия окружены кислородными ионами. Благодаря особенностям структуры, высшие оксиды щелочных металлов обладают высоким плавлением и твердостью.
Свойства высших оксидов щелочных металлов связаны с их химической активностью. Они обладают сильными окислительными свойствами и могут реагировать с различными веществами. Например, оксид калия (К2O) может реагировать с водой, образуя щелочь. Высшие оксиды щелочных металлов также обладают высокой растворимостью в воде и образуют щелочные растворы.
Способность высших оксидов щелочных металлов образовывать ионы при диссоциации в растворах является еще одним важным свойством. Она определяет их электролитическую активность и способность проводить электрический ток в растворах. Так, оксид натрия (Na2O) образует ионы натрия и оксидные ионы, которые способны передавать электроны и образовывать электролитическое растворение.
- Высшие оксиды щелочных металлов также обладают высокой термической стабильностью и способностью сохранять свои свойства при высоких температурах.
- Они часто используются в промышленности, например, в производстве стекла и электродов.
В целом, структура и свойства высших оксидов щелочных металлов определяют их важное значение в химии и технологии, а также их широкое применение в различных областях науки и промышленности.
Формула и методы определения высших оксидов щелочных металлов

Высшие оксиды щелочных металлов являются соединениями, в которых металл образует более высокую степень окисления. В этих соединениях металл обычно имеет положительный заряд, а кислород отрицательный.
Формула высшего оксида щелочного металла может быть определена путем анализа его состава. Количество кислорода, связанного с металлом, определяет степень окисления металла. Обычно формулу высшего оксида обозначают при помощи римских цифр, указывающих на степень окисления.
Определение высших оксидов щелочных металлов может быть выполнено с использованием различных методов. Одним из методов является гравиметрическое определение, которое основано на измерении массы образовавшегося осадка. Другим методом является волюметрическое определение, которое основано на измерении объема реагента, необходимого для полного окисления металла.
Также существуют инструментальные методы определения высших оксидов щелочных металлов, такие как спектрофотометрия. Этот метод позволяет измерять поглощение или испускание света соответствующей длины волны, что позволяет определить концентрацию вещества и, следовательно, степень окисления металла.
Таким образом, формула высшего оксида щелочного металла определяется на основе его состава, а методы определения могут включать гравиметрические, волюметрические или инструментальные методы анализа.
Применение и использование оксидов щелочных металлов в различных областях

Оксиды щелочных металлов являются важными соединениями, используемыми в различных областях. Они широко применяются в химической промышленности, электронике, стекольной промышленности и многих других сферах деятельности.
Один из основных способов использования оксидов щелочных металлов - это в качестве сырья для производства стекол. С помощью оксидов натрия, калия или лития можно получить различные виды стекла с определенными свойствами. Например, оксид натрия обеспечивает прозрачность и устойчивость стекла, оксид калия - улучшает его сопротивление к нагреванию, а оксид лития обеспечивает повышенную прочность.
Оксиды щелочных металлов также используются в производстве керамики. Они добавляются в глину или другие сырьевые материалы для придания керамике особых свойств. Например, добавление оксида калия или натрия делает керамические изделия более прозрачными и устойчивыми к воздействию кислот и щелочей.
В электронике оксиды щелочных металлов находят широкое применение в качестве полупроводников. Например, оксид натрия может использоваться для производства транзисторов, диодов и других электронных компонентов. Оксиды щелочных металлов также используются для создания электролитов в аккумуляторах и батареях.
Кроме того, оксиды щелочных металлов применяются в химической промышленности, в качестве катализаторов в различных реакциях. Они используются для синтеза органических соединений, производства пластмасс, растворителей и других химических продуктов. Некоторые оксиды щелочных металлов также используются в медицине, в качестве компонентов лекарственных препаратов.
Таким образом, оксиды щелочных металлов имеют широкий спектр применения и играют важную роль в различных отраслях промышленности. Их свойства и возможности делают их незаменимыми в производстве стекла, керамики, электроники и химических продуктов.
Взаимодействие высших оксидов щелочных металлов с другими веществами

Высшие оксиды щелочных металлов обладают высокой химической активностью и могут проявлять взаимодействие с различными веществами. Эти вещества могут быть как органическими, так и неорганическими соединениями, а также металлами и неметаллами.
Одним из видов взаимодействия высших оксидов щелочных металлов является реакция с кислотами. При этом оксиды превращаются в соответствующие соли, а кислоты образуют воду. Например, реакция между оксидом натрия и серной кислотой приводит к образованию сульфата натрия и воды:
Na2O + H2SO4 = Na2SO4 + H2O
Другим типичным примером взаимодействия высших оксидов щелочных металлов является реакция с водой. В результате такой реакции образуется щелочная соль и среда становится щелочной. Например, оксид натрия реагирует с водой, образуя гидроксид натрия (щелочь) и высвобождая при этом большое количество тепла:
Na2O + H2O = 2NaOH
Взаимодействие высших оксидов щелочных металлов также может проявляться в реакции с неметаллами. Например, оксид калия может реагировать с хлором, образуя хлорид калия:
2K2O + Cl2 = 2KCl + O2
Иногда высшие оксиды щелочных металлов могут взаимодействовать с металлами. Например, оксид калия может взаимодействовать с медью, образуя купрат калия:
4K2O + Cu = 2K2O·2CuO
Таким образом, высшие оксиды щелочных металлов имеют широкий спектр взаимодействия с другими веществами. Это свойство делает их важными компонентами в химической промышленности и других отраслях науки и техники.
Вопрос-ответ

Какая формула у высшего оксида щелочного металла?
Формула высшего оксида щелочного металла зависит от самого металла. Например, для лития мы имеем формулу Li2O, для натрия – Na2O, для калия – KO и т.д.
Чем отличается высший оксид от нормального оксида?
Высший оксид представляет собой оксид, в котором металл имеет его наибольшую степень окисления. То есть, в нем металл образует наиболее положительные ионы. В отличие от нормального оксида, который образуется, когда металл образует ионы с меньшими зарядами.
Какие свойства обычно имеют высшие оксиды щелочных металлов?
Высшие оксиды щелочных металлов обладают несколькими общими свойствами. Они обычно являются кристаллическими веществами, твердыми на комнатной температуре и безцветными. Они также обладают высокой электроотрицательностью и могут реагировать с водой, образуя щелочные растворы.
Какие примеры высших оксидов щелочных металлов вы знаете?
Примеры высших оксидов щелочных металлов включают оксид лития (Li2O), оксид натрия (Na2O), оксид калия (KO) и оксид рубидия (Rb2O).
