Высшие оксиды щелочных металлов — это соединения, состоящие из щелочных металлов (лития, натрия, калия, рубидия, цезия и франция) и кислорода. Эти соединения обладают необычными физическими и химическими свойствами, что делает их интересными для исследования и практического применения.
Процесс составления высших оксидов щелочных металлов основан на реакции между металлическим щелочным металлом и кислородом. Оксиды щелочных металлов образуются при нагревании соответствующих металлических элементов в кислороде или кислородсодержащем веществе. В результате реакции происходит окисление металла и образование оксида.
Примечательно, что высшие оксиды щелочных металлов обладают необычными структурными особенностями и химическими свойствами. Они могут образовывать различные кристаллические структуры и иметь разную степень оксидации металлического элемента. Кроме того, они могут проявлять кислотные свойства, образуя гидроксиды при реакции с водой, и поддаваться дополнительным окислительным или восстановительным реакциям.
Составление высших оксидов щелочных металлов имеет большое значение для различных областей науки и техники. Например, эти соединения находят применение в качестве катализаторов, активных компонентов в электрохимических системах, а также используются в процессе хемосинтеза различных органических соединений.
Исследование процессов составления и свойств высших оксидов щелочных металлов позволяет расширить наши знания о структуре и свойствах химических соединений. Это открывает новые возможности для разработки новых материалов и технологий, а также позволяет углубиться в понимание основных принципов химических реакций.
Роль высших оксидов щелочных металлов в химических реакциях

Высшие оксиды щелочных металлов, такие как пероксиды и супероксиды, играют важную роль в химических реакциях. Они обладают специфическими свойствами, которые позволяют им использоваться в различных областях науки и техники.
Пероксиды, такие как пероксид водорода (водка) и пероксид бария (оксбарбари) имеют сильные окислительные свойства. Они могут использоваться в процессах окисления органических веществ, таких как перекись водорода в медицине и косметологии, и в производстве окрашивающих веществ.
Супероксиды, такие как супероксид калия (окскалик) и супероксид рубидия (оксрубид), обладают высокой реакционной способностью и могут использоваться в качестве катализаторов в различных химических процессах. Они активно взаимодействуют с молекулами кислорода, что позволяет использовать их для удаления загрязнений в воздухе, очистки воды и процессов горения.
Высшие оксиды щелочных металлов также широко применяются в электрохимии. Они используются в качестве активных материалов в электродных системах, таких как аккумуляторы, горячие щелочные топки и топки прямого назначения. Они обладают высокой электропроводностью и способностью переносить заряды, что делает их незаменимыми компонентами электрохимических устройств.
Таким образом, высшие оксиды щелочных металлов играют важную роль в реакциях окисления, каталитических процессах и электрохимии. Их уникальные свойства обусловливают их широкое применение в различных областях науки и промышленности.
Основные принципы образования высших оксидов
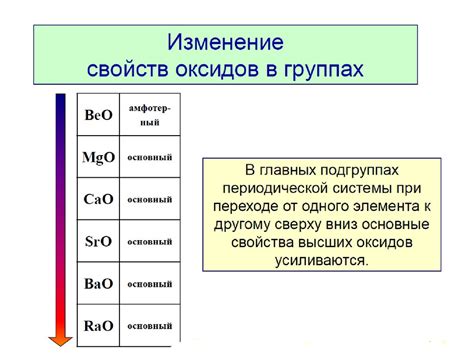
В химии существует класс соединений, полученных путем соединения металла с кислородом - оксидов. Высшие оксиды щелочных металлов обладают особыми свойствами и могут иметь сложную структуру. Они образуются в результате взаимодействия щелочных металлов с кислородом при высоких температурах.
Одним из основных принципов образования высших оксидов щелочных металлов является их способность к положительной окислительной способности. Именно благодаря этому свойству щелочные металлы могут образовывать более высокие оксиды, содержащие большее количество кислорода.
Другим важным принципом образования высших оксидов щелочных металлов является возможность образования комплексных соединений с кислородом. Эти соединения обладают сложной структурой и могут иметь различные степени окисления металла.
Высшие оксиды щелочных металлов также могут образовываться в результате взаимодействия щелочных металлов с кислотными оксидами или кислородсодержащими соединениями. При этом происходит образование сложных структурных единиц, включающих как щелочный металл, так и кислород.
Основные принципы образования высших оксидов щелочных металлов напрямую связаны с их химическими свойствами и структурой. Изучение данных соединений позволяет получить информацию о реакционной способности и возможных применениях щелочных металлов и их соединений в различных областях химии и промышленности.
Реакции образования высших оксидов щелочных металлов

Высшие оксиды щелочных металлов образуются в результате реакции этих металлов с кислородом. Реакции таких оксидов характеризуются высокой энергией и теплотой сгорания.
Одним из способов формирования высших оксидов щелочных металлов является прямое соединение металла с кислородом при высоких температурах. Например, для образования диоксида калия (K2O2) калий нагревают в присутствии кислорода при температуре около 300 градусов Цельсия.
Также возможно образование высших оксидов путем действия однополярного оксигена на молекулярные фрагменты солей щелочных металлов. Например, реакция хлората калия (KClO3) с кислородом приводит к образованию триоксида калия (K2O3) и диоксида калия (K2O2).
- Реакция образования триоксида калия:
- 5KClO3 + 3O2 → 5KCl + 6O3
- 2KClO3 + O2 → 2KClO2 + O3
- 2KClO2 + O2 → 2KClO + O3
- 2KClO + O2 → 2KCl + O3
Таким образом, реакции образования высших оксидов щелочных металлов могут протекать при нагревании металлов с кислородом или при действии оксигена на их соли. Эти реакции имеют большое значение в процессах синтеза и применяются в различных областях науки и промышленности.
Вопрос-ответ

Какие принципы лежат в основе составления высших оксидов щелочных металлов?
Основные принципы составления высших оксидов щелочных металлов включают повышение степени окисления металла и увеличение количества атомов кислорода в оксиде. Это достигается путем использования соответствующих протокислот и воздействия на них высокой температуры.
Какие реакции происходят при составлении высших оксидов щелочных металлов?
При составлении высших оксидов щелочных металлов происходят различные реакции, включающие окисление металла, образование протокислоты и образование самого оксида. Например, при составлении пероксида натрия (Na2O2) натрий окисляется до степени окисления +1, образуется протокислота Na2O, а затем происходит ее реакция с кислородом, образуя пероксидный ион O2^2-. На каждый атом натрия приходятся два атома кислорода.
Можно ли составить оксид с более высокой степенью окисления, чем +2, для щелочных металлов?
Да, для щелочных металлов, включая натрий, калий и литий, можно составить оксиды с более высокой степенью окисления, чем +2. Например, для натрия можно получить пероксид (Na2O2) с +1 степенью окисления или супероксид (NaO2) с +1,5 степенью окисления. Для этого применяются специальные методы, такие как использование соответствующих протокислот и высоких температур.
Какие свойства имеют высшие оксиды щелочных металлов?
Высшие оксиды щелочных металлов обладают рядом уникальных свойств, таких как способность к саморазложению и генерации кислорода при нагревании, а также окислительные свойства. Они также могут образовывать стабильные соединения с водой, образуя пероксиды или гидроксиды, которые могут использоваться в различных химических процессах и применениях.
