Высшая положительная степень окисления – это характеристика элемента, отражающая его способность принять на себя максимальное количество электронов при окислительно-восстановительной реакции. В случае металлов, которые обычно имеют положительные степени окисления, высшая степень окисления является наиболее коррозионно-стойкой. Это приводит к повышенной химической активности металла и его способности участвовать в реакциях.
Определение высшей положительной степени окисления у металлов зависит от уровня окисления остальных элементов в соединении. Однако существует группа металлов, которые образуют стабильные соединения с наивысшими степенями окисления вне зависимости от окружающих условий. К таким металлам относятся, например, рутений (Ru) и иридий (Ir), которые образуют соединения с положительными степенями окисления +8 и +9 соответственно.
Примером металла с высшей положительной степенью окисления является марганец (Mn) с максимальной степенью окисления +7. Марганцевые соединения с такой степенью окисления обладают высокой стабильностью и обычно используются в качестве катализаторов в различных химических реакциях. Также, высшая положительная степень окисления придает марганцу свойство образовывать мощные окислители и способствует его активной реактивности.
Окисление и важность окислительно-восстановительных реакций

Окисление - это химическая реакция, которая приводит к потере электронов веществом. Процесс окисления является фундаментальным для многих химических процессов и играет важную роль в жизни организмов и промышленности.
Окислительно-восстановительные реакции являются основой энергетических процессов в организмах. В митохондриях наших клеток происходят реакции окисления глюкозы, которые позволяют получить энергию для работы клеток. Также, окислительно-восстановительные реакции играют важную роль в дыхании и пищеварении. Благодаря им мы можем обеспечивать наш организм необходимой энергией для жизнедеятельности.
В промышленности окисление имеет большое значение. Окислительные процессы используются для синтеза различных химических веществ, производства электрической энергии, а также в процессах очистки воды и воздуха. Например, процесс окисления аммиака используется в азотной промышленности для синтеза азотных удобрений. Также, окисление алюминия в процессе алюминотермии используется для получения металла из оксида.
Окислительно-восстановительные реакции имеют широкое применение и в аналитической химии. Они используются для определения содержания веществ в образцах, а также для выявления наличия или отсутствия определенных компонентов. Например, окисление водорода перманганатом калия используется как реактив для определения содержания органических веществ в воде.
Окисление как процесс
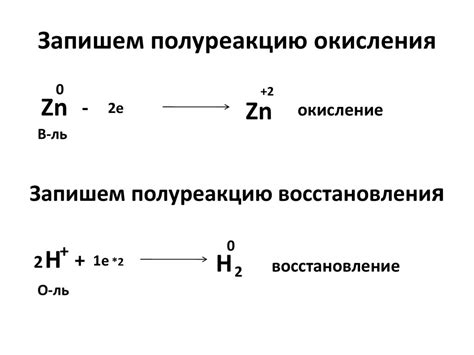
Окисление - это процесс, при котором атомы или ионы теряют электроны, а значит, изменяется их степень окисления. При этом происходит образование соединений с положительной степенью окисления, которые называются оксидами. Окисление является одним из основных химических процессов, происходящих с металлами.
Процесс окисления металлов тесно связан с процессом восстановления - обратной реакцией, при которой атомы или ионы приобретают электроны и возвращаются к исходному состоянию. Все вещества могут подвергаться окислению или восстановлению в зависимости от условий окружающей среды.
Окисление металлов может протекать спонтанно в атмосферных условиях, когда воздух содержит кислород. В результате образуется металлический оксид, который имеет положительную степень окисления металла. Например, железо подвергается окислению и образуется ржавчина - гематит или магнетит.
Высшая положительная степень окисления у металлов связана с их способностью отдавать максимальное количество электронов. Это позволяет им образовывать стабильные оксиды, которые обладают высокой прочностью и стойкостью к коррозии. Примерами таких веществ могут служить оксиды магния (MgO), алюминия (Al2O3) и цинка (ZnO), которые широко применяются в промышленности.
Основные принципы окислительно-восстановительных реакций
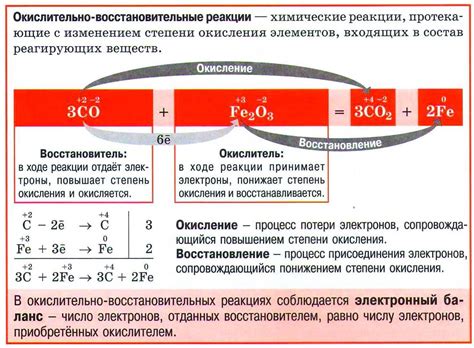
Окислительно-восстановительные реакции, или реакции окисления и восстановления, представляют собой взаимодействия веществ, в которых происходит перенос электронов. В таких реакциях одно вещество (окислитель) получает электроны от другого вещества (восстановитель) с целью достижения стабильного электронного состояния.
При окислении вещество теряет электроны и повышает свою положительную степень окисления, а при восстановлении вещество приобретает электроны, снижая свою положительную степень окисления. Окислитель и восстановитель в окислительно-восстановительной реакции всегда сопряжены и образуют редокс-пару. Одно вещество в реакции окисляется, а другое восстанавливается, поэтому такие реакции называются реакциями окисления-восстановления.
Основными принципами окислительно-восстановительных реакций являются:
- Перенос электронов: Окислитель принимает электроны от восстановителя, происходит перенос электронов между ионами или атомами.
- Ионно-молекулярный механизм: Стадия реакции, связанная с образованием ионов и молекул, является ключевой для процесса окисления и восстановления.
- Балансировка реакции: В окислительно-восстановительных реакциях должны быть соблюдены законы сохранения массы и заряда. Реакцию необходимо сбалансировать по количеству атомов и электронов, чтобы выполнялся принцип сохранения.
Примером окислительно-восстановительной реакции является реакция между металлом и кислородом. Например, железо окисляется при реакции с кислородом воздуха, образуя железооксид. В данной реакции железо служит восстановителем, а кислород - окислителем.
Окисление металлов

Окисление металлов – это процесс, при котором металлы вступают в реакцию с кислородом или другими веществами, образуя соединения, называемые оксидами. В результате окисления металлы теряют электроны и приобретают положительную степень окисления.
Высшая положительная степень окисления у металлов обычно соответствует их наиболее стабильным оксидам. Например, железо окисляется до Fe3+, а медь – до Cu2+. При окислительных реакциях металлы могут образовывать ионы со степенями окисления ниже высшей, но в наиболее распространенных сплавах и соединениях обычно присутствуют ионы с высшими степенями окисления.
Высшая положительная степень окисления у металлов обусловлена их электрохимическими свойствами. Металлы, которые легко отдают электроны при вступлении в реакцию с кислородом, имеют высокую положительную степень окисления. Это связано с тем, что такие металлы обладают низкими энергиями ионизации и аффинитета к электронам, что способствует процессу окисления и образованию положительных ионов.
Примерами металлов с высшей положительной степенью окисления являются хром, марганец, свинец, железо, кобальт, никель и др. Эти металлы широко используются в различных отраслях промышленности, так как обладают высокой химической активностью и способностью образовывать стабильные соединения.
Высшая положительная степень окисления
Высшая положительная степень окисления – это максимальное значение положительного заряда атома металла в химическом соединении. Она свидетельствует о максимальном уровне окислительности данного металла и определяется его способностью отдавать электроны другим атомам или группам атомов.
Металлы имеют различные степени окисления, которые могут быть положительными, отрицательными или нейтральными. Высшую положительную степень окисления обычно обладают наиболее активные металлы, такие как литий (+1), натрий (+1), калий (+1), рубидий (+1), цезий (+1) и франций (+1).
Высшая положительная степень окисления может быть определена с помощью помощью анализа структуры и свойств химических соединений. Например, в соединениях металлов с не металлами, как правило, металл имеет положительную степень окисления, а не металл – отрицательную. Однако в некоторых случаях положительная степень окисления может быть снижена из-за наличия других атомных групп, что делает их более электроотрицательными и способными принимать электроны.
Знание высшей положительной степени окисления металлов является важным при изучении химических свойств веществ и их реакций. Оно позволяет определить электронный баланс и расчеты реакций окисления и восстановления, а также предсказать формирование структуры химических соединений и связей между атомами.
Примеры металлов с высшей положительной степенью окисления

В химии существует ряд металлов, которые проявляют высшую положительную степень окисления в своих соединениях. Одним из таких металлов является хром (Cr). Его высшая положительная степень окисления составляет +VI. Хром образует соединения, в которых электроны переходят с хрома на другие элементы.
Еще одним примером металла с высшей положительной степенью окисления является марганец (Mn). У марганца максимальная положительная степень окисления равна +VII. Марганец образует соединения с высокой степенью окисления, например, в пероксомарганцах.
Также можно упомянуть о металле рутений (Ru). Высшая положительная степень окисления у рутения составляет +VIII. Рутений образует ряд оксидов с высокой степенью окисления, которые проявляются в растворах и при обработке с другими жидкостями.
Другим примером металла с высшей положительной степенью окисления является иридий (Ir). У иридия также максимальная положительная степень окисления равна +VIII. Иридий формирует оксиды, которые имеют структуру с ионами иридия и кислорода. Эти оксиды обладают светокаталитической активностью и используются в различных процессах.
Практическое применение

Высшая положительная степень окисления у металлов имеет широкое практическое применение в различных сферах деятельности, включая науку, инженерию и промышленность.
Один из главных способов использования высшей положительной степени окисления у металлов - это производство различных видов катализаторов. Катализаторы на основе металлов с высшей положительной степенью окисления играют важную роль в химической промышленности, помогая ускорить химические реакции и повысить эффективность процессов.
Еще одним практическим применением высшей положительной степени окисления у металлов является производство различных видов батарей и аккумуляторов. Например, литий-ионные аккумуляторы, широко применяемые в современной электронике, основаны на использовании лития с высшей положительной степенью окисления.
Кроме того, высшая положительная степень окисления у металлов применяется в процессе электролиза, который является важным методом для получения различных металлов из их оксидов. Электролиз позволяет эффективно разложить оксиды металлов и получить их в чистом виде для дальнейшего использования.
Наконец, металлы с высшей положительной степенью окисления также используются в процессе производства керамики и стекла. Различные виды металлов могут использоваться для придания материалам определенных свойств, таких как прочность, плавучесть или устойчивость к высоким температурам.
Вопрос-ответ

Какие металлы имеют наивысшую положительную степень окисления?
Наиболее высокую положительную степень окисления имеют металлы из группы переходных элементов, такие как хром (VI), марганец (VII), молибден (VI), рутений (VIII) и другие. Эти металлы способны образовывать соединения с положительными ионами высокой степени окисления, что связано с наличием большого числа свободных d-электронов в своих внешних энергетических оболочках.
В каких соединениях металлов можно наблюдать наивысшую положительную степень окисления?
Наивысшую положительную степень окисления металлов можно наблюдать в соединениях, где они встречаются в своих самых высоких валентностях. Например, хром может образовывать соединения с положительной степенью окисления +6, такие как хроматы (CrO4^2-) и дихроматы (Cr2O7^2-). Марганец может образовывать соединения с положительной степенью окисления +7, такие как марганаты (MnO4^-). Молибден образует соединения с положительной степенью окисления +6, такие как молибдаты (MoO4^2-). Рутений может образовывать соединения с положительной степенью окисления +8, такие как рутилаты (RuO4^2-).
