Получение металлов является важной задачей в химической промышленности и науке. Металлы используются в широком спектре промышленных процессов и играют важную роль в нашей повседневной жизни. Существует несколько способов получения металлов, каждый из которых основан на определенных химических реакциях.
Один из способов получения металлов - это экстракция. Она основана на использовании растворителя, который способен растворить металл, а затем проводится очистка раствора от примесей. Один из примеров - получение алюминия из его руды боксита. Сначала руду обрабатывают натрием гидроксидом, чтобы получить алюминат натрия, а затем добавляют кислоту, чтобы получить осадок содержащий гидроксид алюминия. Далее с помощью электролиза из гидроксида получают алюминий.
Другой способ получения металлов - это термическое восстановление. В данном случае, металл получается путем реакции окисления металлосодержащего минерала при высокой температуре с добавлением вещества, являющегося восстановителем. Например, для получения железа из его руды, гематита, проводят реакцию с углем. В результате реакции получается оксид углерода и металлическое железо.
И наконец, третий способ получения металлов - это электролиз. В данном случае, реакция происходит с использованием электрического тока. Процесс проводится в качестве электролита, который является раствором соли, в котором содержится металл. На катоде происходит реакция восстановления металла, а на аноде происходит окисление другого вещества. Электролиз используется для получения многих металлов, таких как алюминий, никель, медь и другие.
Основные понятия
Металлы - это химические элементы, обладающие способностью проводить тепло и электричество, имеющие характерный металлический блеск и гибкость. Они являются важными материалами в промышленности и строительстве, а также используются в различных областях, включая электронику, автомобильную промышленность и медицину.
Добыча металлов - процесс извлечения металлов из их природных источников, таких как руды и минералы. Для добычи металлов могут применяться различные методы, включая шахтную добычу, карьерную добычу и гидрометаллургические методы.
Реакции металлов - химические реакции, связанные с взаимодействием металлов с другими веществами. Часто реакции металлов происходят с кислотами, оксидами и водой. Результатом таких реакций может быть образование солей металлов, водорода или других соединений.
Экстракция металлов - процесс получения металлов из их руд или минералов. Для этого применяются различные методы, включая плавку, электролиз и химические реакции. Экстракция металлов может быть сложным и энергоемким процессом, который требует специального оборудования и химических реагентов.
Методы получения металлов - это различные способы, которые используются для получения металлов. Некоторые из них включают плавку руды, в которой металл расплавляется при высоких температурах, электролиз, при котором металл получается путем электрической разложения соединения, и химические реакции, в которых металл образуется в результате взаимодействия с другими веществами.
Реакция разложения

Реакция разложения – это химическая реакция, в результате которой вещество распадается на два или более простых компонента. В контексте получения металлов это означает, что из состава сложного вещества выделяется металлический элемент.
Для проведения реакции разложения обычно требуется использование высоких температур, а иногда и других химических реагентов. Эти условия позволяют разрушить химические связи в молекуле вещества и получить целевой металл.
Примером реакции разложения может служить процесс термического разложения карбонатов металлов. Например, при нагревании карбоната меди (CuCO3) образуется оксид меди (CuO) и выделяется углекислый газ (CO2). Эта реакция может быть представлена уравнением:
CuCO3 → CuO + CO2
Таким образом, путем разложения карбоната меди можно получить оксид меди, который в дальнейшем может быть использован для получения меди.
Реакция разложения является важным способом получения металлов. Она позволяет преобразовать сложные соединения в более простые и выделить нужный металл в достаточно чистом виде.
Реакция с выделением

Реакция с выделением - это один из способов получения металлов, который основан на химической реакции, в результате которой металл выделяется в свободном состоянии. Реакция с выделением может быть использована для получения различных металлов, включая железо, алюминий, медь и многое другое.
Одним из примеров реакции с выделением является электролиз. При электролизе воды, например, на аноде происходит окисление кислорода, а на катоде - восстановление водорода. Таким образом, можно получить водород и кислород в свободном состоянии.
Другим примером реакции с выделением является термическое восстановление. Например, при нагревании оксида меди (II), CuO, восстанавливается медь: CuO + тепло → Cu + О2. В результате реакции восстанавливается медь, которая выделяется в виде металлического порошка.
Некоторые металлы могут быть получены также путем реакции металлического сульфата с алюминием. Например, при взаимодействии медного (II) сульфата с алюминием образуется медь и алюминий сульфат: CuSO4 + Al → Cu + Al2(SO4)3. В результате реакции металлическая медь выделяется из раствора в свободном состоянии.
Реакция окисления-восстановления
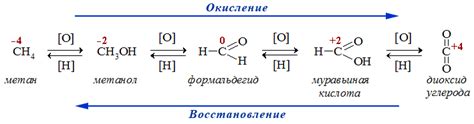
Реакция окисления-восстановления — это химическая реакция, при которой одни вещества передают электроны другим веществам. В результате электронный состав атомов изменяется, что приводит к изменению степени окисления их атомов.
Эти реакции часто протекают с участием металлов. Металлы могут вступать в реакции окисления-восстановления, при этом они могут быть окислены (потерять электроны) или восстановлены (приобрести электроны).
Окисление металлов может происходить в результате реакции с кислородом или кислотами. Например, реакция металла с кислородом приводит к образованию металлической оксиды — типичных окислов металлов. При этом металл теряет электрон(ы) и окисляется.
Восстановление металлов может происходить в результате реакций с веществами, которые восстанавливаются. Например, реакция железа с кислородом дает ржавчину, при этом железо окисляется, а кислород восстанавливается.
Реакции окисления-восстановления могут протекать в различных условиях и в разных средах. Они являются важными процессами в химии и применяются в различных технологических процессах, включая получение металлов из их руд, гальваническое покрытие и электролиз.
Реакция взаимодействия

Получение металлов возможно благодаря реакции взаимодействия с соответствующими реагентами. Эти реакции могут проходить как в растворе, так и в твердом состоянии. Зачастую, для получения металлов из их оксидов или солей необходимо производить специальные химические реакции, используя различные реагенты и условия.
Одним из наиболее распространенных методов получения металлов является реакция с применением электролиза. В этом процессе металл получается благодаря протеканию электрического тока через электролит, в котором растворены соответствующие ионы металла. При этом ионы металла переходят на катод и выпадают на его поверхность в виде металлического осадка. Электролиз применяется, например, для получения меди, никеля, алюминия и других металлов.
Другим способом получения металлов является их выделение путем взаимодействия с активными химическими веществами. Например, реакция металла с кислотой может привести к образованию соли и выделению водорода. Реакция металла с галогеном также может приводить к образованию соли, а в некоторых случаях и к осаждению металлического осадка.
Еще одним методом получения металлов является их экстракция с использованием растворителей. Некоторые металлы можно выделить из их солей, проводя растворение соли в соответствующем растворителе и осаждение металла путем изменения условий (например, путем испарения растворителя).
Важно отметить, что каждый металл имеет свои особенности реакций взаимодействия и специфические методы получения. Поэтому перед проведением экспериментов необходимо тщательно изучить основные свойства и химические реакции каждого конкретного металла.
Реакция с использованием электричества

Один из способов получения металлов — реакция с использованием электричества. Этот метод называется электролизом и основан на применении постоянного электрического тока для превращения соединений металлов в чистое вещество.
Процесс электролиза происходит в специальном аппарате, называемом электролитической ячейкой. Ячейка состоит из двух электродов — анода и катода — и электролита, который может быть в виде расплавленного соли или раствора воды с солью. Анод — это положительно заряженный электрод, на котором происходит окисление металла. Катод — отрицательно заряженный электрод, на котором происходит восстановление металла.
Во время электролиза ионы металла перемещаются от анода к катоду под воздействием электрического тока. При этом окисляемый металл на аноде распадается на положительно заряженные ионы металла и свободные электроны, которые переносятся через внешнюю цепь на катод. На катоде электроны восстанавливают ионы металла, образуя чистое металлическое вещество. Таким образом, происходит "выделение" металла из его соединения.
Для проведения электролиза необходимо подключить электроды к источнику постоянного тока, например, аккумулятору или батарее. Важно также учитывать свойства используемого электролита, так как он должен быть способен проводить электрический ток и иметь достаточное количество ионов металла для электролиза.
Реакция с использованием водорода

Один из способов получения металлов - это реакция с использованием водорода. Водород обладает высокой химической активностью и может реагировать с различными веществами, в том числе с металлами, образуя металловодороды.
Процесс получения металлов с использованием водорода называется восстановлением металлов. В ходе этой реакции водород превращается в простой металл, а соответствующий металлоксид или металлосоль восстанавливается до металлического состояния.
Уравнение реакции восстановления металла в присутствии водорода можно записать в следующем виде:
MnOm + nH2 → nH2O + Mn
где M - металл, n - количество атомов металла, m - количество молекул кислорода.
Например, реакция восстановления меди (II) оксида в присутствии водорода:
2CuO + H2 → H2O + 2Cu
позволяет получить металлическую медь из ее оксида.
Таким образом, реакция с использованием водорода является эффективным и широко используемым способом получения металлов из их соединений.
Вопрос-ответ

Как можно получить железо из руды с помощью химических реакций?
Железо может быть получено из руды с помощью химических реакций. Например, руда может быть подвергнута обогащению, чтобы отделить железо, затем ее можно смешать с коксом (угольным топливом) и известью (кальцинированным известняком) и поместить в печь для восстановительной обработки. В результате химической реакции, происходящей в печи, окисленная руда превращается в железо и шлак. Железо может быть отделено от шлака и использовано для различных целей.
