Электролиз – процесс, при котором осуществляется разложение вещества под действием электрического тока. Один из наиболее распространенных методов электролиза заключается в погружении двух электродов в раствор соли и пропускании через него постоянного тока. При этом на катоде происходит выделение металла, а на аноде – выделение кислорода или иной окисляющейся вещества.
Однако, в некоторых случаях металл не выделяется на катоде при электролизе раствора соли. Этот эффект объясняется особенностями химической реакции, происходящей на электродах. Восстановление ионов металла до нейтрального состояния требует введения дополнительной энергии.
Так, когда в растворе соли присутствует металл, который образует стабильный соединенный ион (как, например, в случае хлорида серебра AgCl), электролиз этого раствора не приводит к выделению металла на катоде. Для его разложения необходимо создание условий, при которых энергия реакции восстановления ионов металла превышает энергию реакции окисления воды на аноде.
Механизм электролиза раствора соли
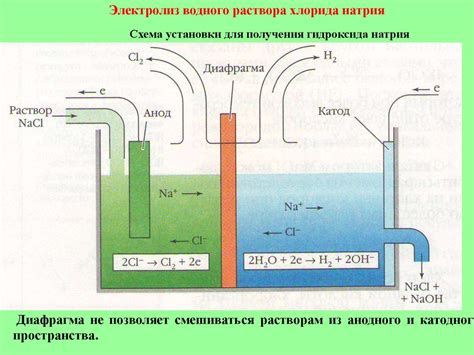
Электролиз раствора соли основан на процессе разложения соли на положительные и отрицательные ионы под воздействием электрического тока. В ходе электролиза, положительное напряжение подается к аноду, который является местом окисления, а отрицательное напряжение подается к катоду, где происходит процесс восстановления.
Когда раствор соли подвергается электролизу, катод притягивает положительные ионы из раствора, которые могут быть металлами или водородом. Если металл присутствует в растворе соли, то он будет депонироваться на катоде в виде металлического осадка. Однако, если металл отсутствует в растворе, то на катоде будет образовываться водородный газ.
При процессе электролиза раствора соли, металл не выделяется, если его концентрация в растворе недостаточна или отсутствует. В этом случае, водородные ионы собираются на катоде и образуют молекулы водорода, которые выделяются в виде газа.
Процесс ограничения выделения металла

Электролиз — это процесс, при котором электрический ток применяется для промышленного получения различных веществ. Во время электролиза раствора соли, например, происходит разложение этого раствора на ионы с помощью электрического тока. При этом, обычно, одно из веществ выделяется на электроде, а другое — на катоде.
Однако, в некоторых случаях процесс электролиза может ограничить выделение металла. Это может происходить по нескольким причинам. Во-первых, раствор может содержать только ионы того металла, который мы хотим выделить. В таком случае, металл будет накапливаться на катоде.
Во-вторых, реакция выделения металла на катоде может протекать слишком медленно. Это может быть связано с тем, что реакция требует большого количества энергии. В таком случае, выделение металла будет происходить медленно и может быть слишком мало заметно.
Также, процесс ограничения выделения металла может быть связан с конкуренцией других реакций на электроде. Если на электроде протекает другая реакция, которая быстрее выделяется, то металл будет выделяться в меньшем количестве или не будет выделяться вообще.
Все эти факторы влияют на процесс выделения металла при электролизе раствора соли. Понимание этих факторов позволяет контролировать процесс электролиза и улучшить его эффективность.
Влияние концентрации раствора

Концентрация раствора является важным фактором, влияющим на электролиз. При низкой концентрации раствора соли, содержащей металл, можно наблюдать избирательность процесса электролиза.
В растворах с низкой концентрацией металлической соли количество свободных ионов металла будет значительно меньше, что снижает вероятность их достижения электрода и восстановления в металлическую форму.
Наоборот, в растворах с более высокой концентрацией соли количество свободных ионов металла будет больше, что способствует более интенсивному отделению металлического осадка на электроде.
Таким образом, может быть достигнут баланс между скоростью электролиза и выделением металла в растворе с оптимальной концентрацией соли.
Важно отметить, что концентрация раствора не является единственным фактором, влияющим на процесс электролиза, но она играет значительную роль при определении количества металла, выделяемого на электродах.
Факторы, влияющие на выделение металла

Выделение металла при электролизе раствора соли зависит от нескольких факторов. В первую очередь, важную роль играет электрод, на который осуществляется осаждение металла. Электрод должен быть сделан из материала, способного выдерживать высокие температуры и агрессивные условия среды. Электрод также должен иметь правильную форму и площадь поверхности, чтобы обеспечить эффективный процесс осаждения металла.
Однако выбор электрода не является единственным фактором, влияющим на выделение металла. Важную роль играет также концентрация металлов в растворе. Чем выше концентрация металла, тем быстрее происходит его осаждение на электроде. Высокая концентрация металла также позволяет получать чистый металл без примесей.
Еще одним важным фактором является ток электролиза. Чем больше ток, тем интенсивнее происходит процесс осаждения металла на электроде. Однако слишком высокий ток может привести к возникновению других электрохимических реакций, которые могут повлиять на качество металла.
Также следует отметить, что выделение металла при электролизе зависит от свойств самого металла. Некоторые металлы обладают высокой степенью осаждения и могут легко выделяться при условиях электролиза, в то время как для других металлов требуется определенная температура и время для успешного осаждения.
Итак, выделение металла при электролизе раствора соли зависит от нескольких факторов, включая выбор электрода, концентрацию металла в растворе, ток электролиза и свойства самого металла. Учет этих факторов позволяет эффективно осуществлять процесс выделения металла при электролизе.
Вопрос-ответ

Почему металл не выделяется при электролизе раствора соли?
При электролизе раствора соли, металл может не выделяться по нескольким причинам. Во-первых, это может быть связано с низким потенциалом окисления металла. Если потенциал окисления металла выше потенциала водорода, то вместо металла выделяется водород. Во-вторых, металл может выделяться, но он остается в растворе в виде ионов, а не образует непосредственно металлический осадок. Это может происходить из-за высокой концентрации ионов металла в растворе или наличия других реагентов, которые могут образовывать стабильные комплексы с металлами. Кроме того, при электролизе раствора соли может образовываться пленка оксида на поверхности металла, которая препятствует дальнейшей реакции.
Почему металл не выделяется при электролизе соли в воде?
Один из возможных объяснений заключается в том, что для того чтобы металл выделился при электролизе соли в воде, его потенциал окисления должен быть выше потенциала водорода в данной системе. Если потенциал окисления металла ниже потенциала водорода, то выделяться будет водород. Кроме того, если раствор соли содержит высокую концентрацию металлических ионов или других реагентов, способных образовывать стабильные комплексы с металлами, то металл может оставаться в растворе, не образуя непосредственно металлический осадок.
Какой металл выделяется при электролизе раствора соли?
Металл, который будет выделяться при электролизе раствора соли, зависит от конкретного металла, содержащегося в соли. Если в растворе содержатся ионы металла, чей потенциал окисления выше потенциала водорода, то выделится этот металл. Например, при электролизе раствора медного купатила (CuSO₄) на аноде выделяется кислород, а на катоде – медь. Если же потенциал окисления металла ниже потенциала водорода, то на катоде будет выделяться водород вместо металла. Например, при электролизе раствора натриевой соли (NaCl) на катоде будет образовываться водород.
