Вычисление эквивалента металла при пропускании через раствор является важным этапом в изучении процессов окисления и восстановления, которые происходят в химических реакциях.
В химической лаборатории существует несколько методов для определения эквивалента металла. Один из самых распространенных методов – это метод кульометрии, основанный на использовании электрического тока.
Основной идеей метода кульометрии является пропускание постоянного тока через раствор, содержащий исследуемый металл. Уравнение неразложимого вещества в растворе можно записать как:
Mn+ + ne- → M
Здесь M обозначает металл, n+ – его степень окисления, e- – электроны, а n – количество переносимых электронов. Зная количество перенесенных электронов и массу металла, можно рассчитать эквивалент металла.
Сущность метода определения эквивалента металла

Метод определения эквивалента металла является одним из основных в химическом анализе. Он основан на пропускании металла через раствор и измерении количества произведенного вещества.
Прежде всего, необходимо иметь образец металла, который будет подвергаться анализу. Затем, этот образец помещается в раствор, который содержит соответствующий химический реагент. При этом, происходит химическая реакция между металлом и реагентом, образуя новое вещество либо осадок.
Далее происходит измерение количества полученного вещества, например, с помощью взвешивания осадка. Зная количество использованного металла и количество полученного вещества, можно вычислить эквивалент металла - то есть количество металла, эквивалентное произведенному веществу.
Установление эквивалента металла по этому методу является важным для различных промышленных отраслей. Например, в металлургии данный метод может применяться для определения эффективности используемых металлов или для контроля качества производимых материалов.
В целом, метод определения эквивалента металла позволяет получить количественные данные о реакциях между металлом и реагентом, что помогает в дальнейшем использовании металла в различных процессах и приложениях.
Что такое эквивалент металла?
Эквивалент металла - это величина, которая позволяет сравнивать различные металлы по их химической активности. Она определяет не только массу металла, но и его способность взаимодействовать с другими веществами. Эквивалент металла обычно используется в химических реакциях или процессах, где металл вступает во взаимодействие с раствором или другими веществами.
Эквивалент металла можно рассчитать, используя понятие эквивалентной массы, которая определяет массу металла, соответствующую одному мольному количеству или атомному весу данного металла. Таким образом, эквивалент металла зависит от его атомного веса и степени окисления.
В химических расчетах эквивалент металла позволяет определить количество растворенного металла или массу металла, необходимую для процесса. Например, при процессе электролиза эквивалент металла определяет количество металла, которое осаждается на электроде при заданном количестве электричества.
Также эквивалент металла может быть полезен при проведении экспериментов, связанных с определением активности металла в растворе. Путем сравнения эквивалентов различных металлов можно определить их химическую активность и способность реагировать с другими веществами.
Зачем необходимо определение эквивалента металла?

Определение эквивалента металла играет важную роль в химических и аналитических исследованиях. Эквивалент металла – это масса металла, которая эквивалентна одной мольной массе вещества, с которым взаимодействует данный металл.
Определение эквивалента металла позволяет решать множество задач, связанных с исследованием металлов и их взаимодействия с другими веществами:
- Определение прочности сплавов и сталей. Зная эквивалент металла, можно подобрать верные компоненты для создания прочных и долговечных конструкций.
- Исследование кинетики химических реакций. Эквивалент металла позволяет определить скорость реакции и оценить эффективность катализаторов.
- Определение концентрации растворов. Зная эквивалентную массу металла, можно рассчитать концентрацию вещества в растворе и провести анализ его состава.
- Расчет электрохимических явлений. Эквивалент металла позволяет определить электродные потенциалы, провести электролиз и решить другие задачи электрохимии.
Определение эквивалента металла важно для многих отраслей науки и техники. Оно позволяет получить более точные результаты и усовершенствовать процессы производства и синтеза веществ. Также, зная эквивалент металла, можно предвидеть его поведение в различных условиях и применять его в разных промышленных процессах.
Принцип определения эквивалента металла

Определение эквивалента металла при пропускании через раствор является важной задачей в аналитической химии. Данный процесс основан на осаждении металла на электроде постепенно, позволяя определить точное количество металла, которое растворялось в растворе.
Для определения эквивалента металла применяются различные методы, одним из которых является гравиметрический метод. При этом методе, осадок металла, полученный после пропускания через раствор, взвешивается и на основе его массы определяют эквивалент металла. Этот метод позволяет получить результаты с высокой точностью и надежностью.
Кроме гравиметрического метода, также широко используется электрохимический метод определения эквивалента металла. При этом методе, используется электрод, на который осаждается металл из раствора. Затем проводится измерение электрического тока, проходящего через электрод. Исходя из этого значения, можно определить эквивалент металла.
Для более точных результатов, часто применяются методы определения эквивалента металла с использованием стандартных растворов, которые имеют известную концентрацию металла. Путем сравнения реакции между стандартным раствором и неизвестным раствором, можно определить эквивалент металла в неизвестном растворе.
Таким образом, определение эквивалента металла при пропускании через раствор основано на гравиметрическом и электрохимическом методах. Эти методы позволяют определить точное количество металла в растворе и применяются в аналитической химии для выполнения различных исследований и анализов.
Анализ пропускания через раствор

Анализ пропускания через раствор - это метод, который позволяет определить содержание определенного металла в растворе. Он основан на способности металла проходить через растворы. Через раствор проходят только те металлы, которые находятся в растоворе в виде ионов.
Для проведения анализа пропускания через раствор необходимо сначала приготовить раствор, в котором находится исследуемый металл. Затем этот раствор помещают в специальную ячейку, через которую пропускается электрический ток. При прохождении тока через раствор происходят окислительно-восстановительные реакции, в результате которых металл переходит в другую форму или выпадает на электроды.
Одним из основных параметров, характеризующим пропускание металла через раствор, является эквивалентное количество металла. Это количество определяется путем измерения количества электричества, протекшего через раствор, и его соотношения с электрохимическим эквивалентом металла - величиной, равной массе металла, относящейся к количеству электричества, необходимому для его окисления или восстановления.
Анализ пропускания через раствор имеет широкое применение в различных областях, таких как химия, металлургия, фармакология и др. Этот метод позволяет изучать различные свойства металлов, их взаимодействие с другими веществами и процессы, происходящие в растворе.
Использование реакций окисления-восстановления
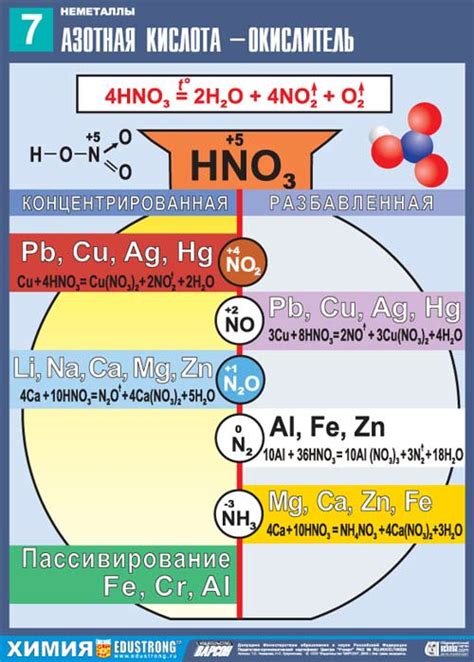
Реакции окисления-восстановления играют важную роль при вычислении эквивалента металла при пропускании через раствор. Эти реакции основаны на передаче электронов между веществами, что позволяет определить степень окисления и восстановления соответствующих элементов.
Процесс окисления предполагает потерю электронов, в то время как процесс восстановления связан с их приобретением. В реакциях окисления-восстановления электроны передаются от анодного вещества к катодному в результате проведения электрического тока через раствор.
Для проведения эксперимента необходимо использовать два электрода – анод и катод. Анодом выступает металл, который подлежит окислению, в то время как катодом является металл, который будет восстанавливаться. При пропускании тока через раствор происходит процесс окисления анодного металла, а электроны, выделяющиеся при этом, переносятся на катодный металл, приводя к его восстановлению.
На основе измерений тока потребления и тока выделения можно вычислить эквивалент анодного металла при его окислении и восстановлении, что позволяет определить его массу как массу катодного металла, полученного при окислении анода. Таким образом, использование реакций окисления-восстановления позволяет определить эквивалент металла при пропускании через раствор.
Нюансы определения эквивалента металла

Эквивалент металла – это показатель, позволяющий определить массу вещества, которое может быть получено или растворено веществом данного металла при определенных условиях. Определение эквивалента металла является важным этапом в химических и аналитических исследованиях.
Определение эквивалента металла может проводиться различными методами, в зависимости от химического или аналитического задания. Одним из наиболее используемых методов является метод произвести и страницуирования.
Метод произведений и страницуирования основан на определении количества вещества металла, необходимого для образования определенного количества соли. Для этого сначала выделяют металл из вещества, затем полученный металл пропускают через раствор соли другого металла и определяют количество вещества того металла, которое растворилось.
При определении эквивалента металла важно учитывать условия проведения эксперимента, такие как концентрация растворов, температура, время пропускания металла через раствор и другие факторы. Все эти параметры могут влиять на результаты определения эквивалента металла и требуют тщательного контроля.
Определение эквивалента металла является важной задачей в химии и находит свое применение в различных областях, таких как производство металлов, аналитическая химия, фармацевтическая промышленность и другие. Точное определение эквивалента металла позволяет решать различные задачи, связанные с производством и обработкой металлов.
Учет концентрации раствора
Один из ключевых аспектов при вычислении эквивалента металла при пропускании через раствор является учет концентрации раствора. Концентрация раствора определяет количество растворенного вещества, которое содержится в единице объема раствора.
Для успешного и точного определения эквивалента металла необходимо знать концентрацию раствора, так как она влияет на скорость реакции и количество проходящего через раствор вещества. При использовании раствора с низкой концентрацией, эквивалент металла будет рассчитываться по особым формулам, а при использовании раствора с высокой концентрацией, может потребоваться дополнительная обработка результатов.
Для измерения концентрации раствора применяются различные методы, такие как гравиметрический, визуальный, спектрофотометрический и другие. Определение концентрации является важным этапом, поскольку на него влияют не только результаты самого эксперимента, но и точность самого метода вычисления эквивалента металла.
Вопрос-ответ

Как можно вычислить эквивалент металла, если раствор является сложным и содержит несколько металлов?
Если раствор содержит несколько металлов, то для вычисления общего эквивалента металла можно использовать метод электроколичественного анализа. В этом методе осуществляется электролиз раствора с помощью постоянного тока, и на аноде или катоде осаждаются металлы. По количеству осажденных металлов можно определить их эквивалентные массы и, соответственно, эквивалент металла в исходном растворе.
Какие факторы могут влиять на вычисление эквивалента металла при пропускании через раствор?
Вычисление эквивалента металла при пропускании через раствор может зависеть от различных факторов, включая концентрацию металла в растворе, температуру раствора, время пропускания и ток электролиза. Все эти факторы могут оказывать влияние на скорость и полноту осаждения металла на электроде.
Можно ли использовать вычисление эквивалента металла при пропускании через раствор в промышленности?
Вычисление эквивалента металла при пропускании через раствор широко используется в промышленности. Этот метод позволяет определять содержание металлов в растворах, а также контролировать качество и состав промышленных продуктов. Например, в металлургии вычисление эквивалента металла может использоваться для контроля содержания примесей в стали или определения концентрации металлов в руде или шлаке.
Какие другие методы можно использовать для вычисления эквивалента металла, кроме пропускания через раствор?
Помимо вычисления эквивалента металла при пропускании через раствор, существуют и другие методы анализа металлов. Например, можно использовать спектральный анализ, при котором измеряется поглощение или испускание характеристических линий металла, или методы вольтамперометрии, кулонометрии и масс-спектрометрии, основанные на измерении электрических или массовых характеристик металла.
