Определение массы прореагировавшего металла по объему выделившегося водорода является одним из наиболее распространенных методов в аналитической химии. Этот метод позволяет определить точную массу металла, прореагировавшего с кислородом воды и выделившегося в виде водорода. Главная особенность этого метода заключается в том, что все вычисления основываются на законе Лавуазье – азот воздуха, соприкасаясь с кислородом, образует азотную кислоту, обязательно учитывается в плане массы.
Исходя из этого, методика вычисления массы прореагировавшего металла по объему выделившегося водорода предполагает следующие этапы. Вначале проводятся предварительные эксперименты, чтобы определить, сколько газа выделяется водородом в зависимости от массы металла. Затем определяется количество газа, выделившегося во время эксперимента, и на основе этой информации вычисляется масса прореагировавшего металла.
Важно отметить, что для достижения точных результатов при определении массы металла необходимо соблюдать ряд условий. Во-первых, эксперимент необходимо проводить в закрытой системе, чтобы избежать утечки газа и получить точные данные. Во-вторых, перед началом эксперимента массу металла необходимо точно измерить, чтобы исключить погрешности в вычислениях. Также важно учитывать состояние металла и его реакционную способность, так как различные металлы могут иметь разную степень реакционной активности.
Определение массы прореагировавшего металла

Для определения массы прореагировавшего металла по объему выделившегося водорода используется специальная методика. Этот метод основан на законе Ома-Лекланша, который устанавливает пропорциональность между массой металла и количеством выделившегося водорода.
Первым шагом в процессе определения массы прореагировавшего металла необходимо получить достаточное количество водорода. Для этого металл помещается в реакционную плоскостью стеклянную колбу, наполненную определенным объемом кислоты. При взаимодействии металла с кислотой происходит химическая реакция, в результате которой выделяется водород.
Далее, необходимо собрать выделившийся водород в специальный газообразный сборник, соединенный с колбой. Объем выделившегося водорода измеряется с помощью градуированной шкалы на сборнике.
Затем, по полученному объему водорода можно рассчитать массу прореагировавшего металла согласно закону Ома-Лекланша. Для этого используется таблица соответствия между массой металла и объемом выделившегося водорода. Путем интерполяции можно определить массу металла, соответствующую измеренному объему водорода.
Таким образом, методика вычисления массы прореагировавшего металла по объему выделившегося водорода позволяет на основе экспериментальных данных получить точные результаты, которые могут быть использованы в различных химических и физических исследованиях.
Принцип методики
Методика вычисления массы прореагировавшего металла по объему выделившегося водорода основана на простом принципе химической реакции между металлом и разбавленной кислотой.
Для проведения эксперимента необходимо взвесить определенное количество металла и поместить его в реакционный сосуд, заполненный кислотой. Кислота растворяет металл, образуя соли и выделяя водородный газ.
Выделившийся водородный газ собирается в специальной аппаратуре, например, надводородном аппарате или водородно-воздушной камере, где его объем можно легко измерить.
Количество выделившегося водорода пропорционально количеству прореагировавшего металла. Исходя из соотношения между водородом и металлом в химической реакции, можно вычислить массу металла, который прореагировал.
Методика вычисления массы прореагировавшего металла по объему выделившегося водорода широко используется в лабораториях для определения содержания металлов в различных материалах, таких как сплавы, руды и прочие пробоподготовленные материалы.
Описание эксперимента

Эксперимент по вычислению массы прореагировавшего металла по объему выделившегося водорода позволяет определить количество металла, прореагировавшего с кислотой на основе объема выделившегося газа. Для проведения эксперимента требуются следующие компоненты: металлический образец, кислотное растворение (например, соляная кислота или серная кислота), градуированный сосуд с водой, газовая колба с непрозрачными стенками и резиновая пробка с двумя отверстиями.
Эксперимент начинается со взвешивания металлического образца и измерения его массы. Затем образец помещается в газовую колбу, а колба заполняется водой таким образом, чтобы уровень воды был выше отверстия в колбе. Колба плотно закрывается резиновой пробкой с двумя отверстиями, одно из которых соединяется с колбой, а другое - с градуированным сосудом с водой.
Далее в колбу через одно из отверстий пробки вводится кислотное растворение. При взаимодействии кислоты с металлом выделяется водород, который поднимается в верхнюю часть колбы и выталкивает из нее определенный объем воды. Это приводит к понижению уровня воды в сосуде.
После того, как реакция между металлом и кислотой завершена, измеряется изменение уровня воды в сосуде. Это позволяет вычислить объем выделившегося водорода. Зная объем выделившегося газа и реакционную схему реакции, можно определить количество металла, прореагировавшего с кислотой. Для этого используется соотношение между объемом газа и количеством вещества, которое определяется по уравнению реакции.
Таким образом, методика вычисления массы прореагировавшего металла по объему выделившегося водорода является одним из способов определения количества металла, прореагировавшего с кислотой. Этот эксперимент широко применяется в химических лабораториях для анализа металлических образцов и контроля качества материалов.
Подготовка образцов металла

Подготовка образцов металла является важным этапом в методике вычисления массы прореагировавшего металла по объему выделившегося водорода. Для проведения эксперимента необходимо иметь образцы металла заданного размера и формы.
В первую очередь необходимо подобрать металлические образцы, которые будут использоваться в эксперименте. Образцы металла должны быть чистыми и не иметь поверхностных дефектов, таких как окислы или загрязнения.
После выбора образцов металла следует их очистить. Это можно сделать путём механической обработки, например, с помощью абразивных материалов. Также можно применить химическую обработку, используя растворы для удаления окислов и загрязнений.
После очистки образцов металла следует провести их маркировку. На каждом образце должна быть нанесена информация, например, название металла, его серийный номер и дата проведения эксперимента. Это позволит не только идентифицировать каждый образец, но и провести последующий анализ результатов эксперимента.
Создание условий реакции металла с водой

Для того чтобы произошла реакция металла с водой, необходимо создать определенные условия, которые способствуют активации химического процесса. Одним из важных аспектов является подготовка пробирки, в которой будет проходить реакция. Пробирка должна быть чистой и сухой, чтобы исключить возможность взаимодействия металла с посторонними веществами.
Далее следует выбрать подходящий металл для проведения эксперимента. Обычно для этой цели используют металлы, такие как цинк, алюминий или железо. Эти металлы обладают способностью активно взаимодействовать с водой, образуя гидроксиды и выделяя водород. Реакция происходит при комнатной температуре и не требует применения дополнительных искусственных условий.
Для более эффективной реакции металла с водой можно добавить примесь катализатора. Катализаторы способствуют активации и ускорению химического процесса. Одним из примеров катализаторов может быть капля кислоты (например, серной, соляной или уксусной), которая обеспечивает активацию металла и способствует выделению большего объема водорода.
Необходимо также учесть, что реакция металла с водой может протекать в разных условиях в зависимости от концентрации веществ. Более разбавленная вода может вызвать более медленную реакцию, в то время как более концентрированный раствор может привести к более интенсивной реакции. Подбор оптимальной концентрации воды требует предварительного исследования и опытного подхода.
Измерение объема выделившегося водорода
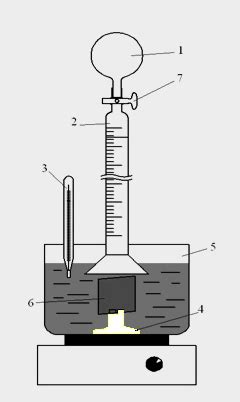
Для определения массы прореагировавшего металла методом вычисления по объему выделившегося водорода необходимо измерить точный объем газа, который образуется в результате реакции.
Прежде всего, необходимо подготовить специальное сосуд, в котором будет происходить сбор и измерение выделившегося водорода. Этот сосуд должен быть герметичным и иметь возможность измерения объема газа в нем.
Далее, следует подготовить пробирку с реактивом, содержащим металл, который будет реагировать с водой и выделять водород. Пробирку с реактивом нужно оснастить газовым соплом, чтобы выделяющийся газ мог направляться в специальный сосуд.
Сосуд с газообразным веществом размещается над водой в водяной бане или другом аналогичном ёмкости. Под газосодержащую стеклянную трубку помещается маркерный цилиндр, который позволяет контролировать изменение объема газа.
Для измерения объема выделившегося водорода используется простой эффект закона Архимеда, согласно которому под действием выталкивающей силы вещество частично или полностью выталкивается из жидкости. Объем водорода определяется путем измерения изменения уровня жидкости в маркерном цилиндре.
Измерения проводятся с определенной периодичностью, чтобы убедиться в завершенности реакции и получить более точные результаты. Полученные значения объема водорода позволяют вычислить массу прореагировавшего металла по известным физическим константам.
Расчет массы прореагировавшего металла
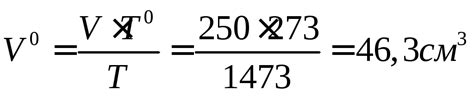
Для определения массы прореагировавшего металла с помощью методики вычисления объема выделившегося водорода необходимо провести следующие шаги.
В первую очередь, необходимо взять определенное количество металла, измеренное в граммах, и поместить его в реакционную колбу, залить соляной кислотой и закрыть колбу пробкой с нагнетательным устройством, связанным с счетчиком объема выделившегося водорода.
Затем необходимо аккуратно открывать кран на нагнетательной трубке и медленно закачивать водород в реакционную колбу до полного выделения металла. При этом необходимо точно измерить объем выделившегося водорода.
Далее, с использованием закона Дальтона и учета пропорций химической реакции, можно вычислить массу прореагировавшего металла, соответствующего объему выделившегося водорода.
Важно отметить, что для точности результатов необходимо учесть температуру и давление воздуха, а также провести несколько повторных измерений и усреднить полученные значения.
Оценка погрешности и точности методики

В процессе вычисления массы прореагировавшего металла по объему выделившегося водорода возможны погрешности и неопределенности, которые влияют на точность и достоверность результатов. Погрешность - это разница между полученным значением и истинным значением измеряемой величины, а точность - это степень близости результатов измерений к истинным значениям.
Одной из основных источников погрешности является неточность при проведении эксперимента. Например, возможны ошибки измерения объема выделившегося водорода, ошибки в весе и начальном количестве металла, а также неучтенные факторы, влияющие на процесс реакции.
Для оценки погрешности и точности методики необходимо провести серию повторных измерений одной и той же реакции на однородных образцах металла. После этого можно провести статистическую обработку данных, определить среднее значение, стандартное отклонение и доверительный интервал. Чем меньше стандартное отклонение, тем более точными будут результаты измерений.
Для повышения точности методики также можно использовать контрольные точки, которые позволят сравнить результаты с другими известными методами измерения массы металла. Это позволит установить корректность и надежность проводимых вычислений.
Важно отметить, что достижение высокой точности и надежности методики возможно только при соблюдении всех условий эксперимента, использовании точного оборудования и аккуратном проведении измерений. Процесс оценки погрешности и точности методики является неотъемлемой частью научных исследований и позволяет получить объективные результаты и выводы.
Вопрос-ответ

Как вычислять массу металла по объему выделившегося водорода?
Масса металла может быть вычислена по формуле: масса металла = (молярная масса водорода * объем выделившегося водорода) / (2 * мольная масса металла)
Какая формула используется для расчета массы прореагировавшего металла?
Для расчета массы прореагировавшего металла можно использовать формулу: масса металла = (мольная масса водорода * объем выделившегося водорода) / (2 * мольная масса металла)
В чем состоит методика вычисления массы металла по объему выделившегося водорода?
Методика вычисления массы металла по объему выделившегося водорода основана на химическом уравнении реакции между металлом и кислотой или водой, где известны молярные массы водорода и металла, а объем выделившегося водорода определяется экспериментально. Для расчета массы металла используется формула: масса металла = (мольная масса водорода * объем выделившегося водорода) / (2 * мольная масса металла)
