Реакция металла с его оксидом является одним из основных процессов в химии. Она позволяет определить содержание металла в его минеральной руде или концентратах. При этом важно знать методы вычисления эквивалентов металла, которые позволяют провести анализ с высокой точностью.
Один из способов вычисления эквивалентов металла при реакции с его оксидом – это методику щелочного периода, основанную на реакции окисления нулевой степени. При этом металлический оксид реагирует с щелочью, образуя гидроксид металла.
Другим способом является методика ионного баланса, основанная на том, что вещества в реакции должны быть электронейтральными. При этом вычисляются молярные проценты элементов в металлическом оксиде и оксиде металла. После расчетов можно определить эквивалентность металла.
Как использовать реакцию с оксидами для вычисления эквивалентов металла?

Реакция металлов с их соответствующими оксидами является одним из методов для определения эквивалентов металла. Этот метод основан на принципе стехиометрии, где вещества реагируют в определенных пропорциях. Для проведения данной реакции необходимо знать молярную массу металла и его оксида, а также молярные коэффициенты реакции.
Для вычисления эквивалентов металла можно использовать следующую формулу: эквиваленты металла = масса металла / массу одной эквивалентной порции металла. Для этого необходимо определить массу металла, который был потребован для полного превращения оксида.
Примером реакции, которая может быть использована для вычисления эквивалентов металла, является реакция меди с ее оксидом. Медь может реагировать с кислородом в оксидную форму, например, оксид меди(II). Реакция меди с оксидом меди осуществляется по уравнению Cu + CuO → 2Cu. В данном случае, масса меди используется как мерило для вычисления эквивалентов металла.
Реакция с оксидами может быть использована для определения эквивалентов металла в лаборатории и в промышленности. Этот метод позволяет точно установить количество металла, которое превращается в оксид, и на основе этого вычислить эквиваленты металла. Он широко используется для анализа, исследования и производства металлических изделий.
Определение эквивалента

Определение эквивалента является одним из ключевых понятий при рассмотрении реакций металлов с их оксидами. Эквивалент - это количество вещества, которое обладает такой же способностью к химическим реакциям, как заданное количество другого вещества.
Для определения эквивалента металла при реакции с его оксидом необходимо знать стехиометрию реакции, то есть соотношение между металлом и его оксидом. Оно может быть выражено числами или массами веществ.
Важным понятием при определении эквивалента является валентность металла, которая определяет, сколько зарядов он может отдать или принять при реакции с оксидом. Валентность металла указывается в реакционном уравнении в виде индекса перед символом металла.
Для вычисления эквивалента металла можно использовать формулу, в которой присутствуют масса металла и его валентность. Эквивалент металла равен массе металла, деленной на его валентность.
Определение эквивалента имеет практическое значение в химических расчетах, так как по нему можно вычислить необходимые количества веществ для проведения реакции с заданными условиями.
Свойства оксидов металлов
Оксиды металлов – это неорганические соединения, состоящие из атомов металла и кислорода. Они обладают рядом характеристических свойств, которые определяют их важное значение в различных областях промышленности и науки.
Физические свойства оксидов металлов. Большинство оксидов металлов имеют высокую температуру плавления и кипения, что делает их полезными в качестве катализаторов и материалов для высокотемпературных процессов. Кроме того, оксиды металлов обладают электропроводностью, что находит применение в электронике и электротехнике.
Химические свойства оксидов металлов. Оксиды металлов часто обладают кислотными свойствами, что проявляется в их способности взаимодействовать с основаниями и образовывать соли. Кроме того, они могут выступать в реакциях окисления и восстановления, играя важную роль в химических процессах.
Применение оксидов металлов. Из-за своих свойств, оксиды металлов находят широкое применение в различных отраслях промышленности. Например, оксид железа (Fe2O3) используется в производстве стали, а оксид алюминия (Al2O3) – в качестве абразивного материала. Кроме того, некоторые оксиды металлов имеют фармацевтические свойства и применяются в медицине.
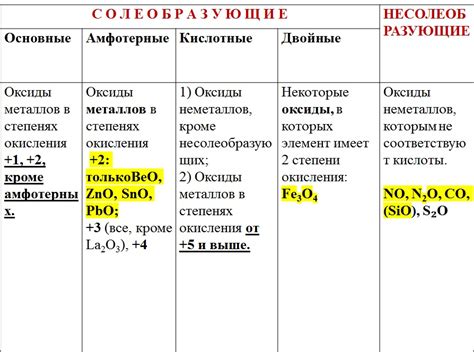
Типы оксидов металлов. Оксиды металлов можно разделить на две основные категории: основные и амфотерные. Основные оксиды реагируют с кислотами, образуя соли. Примером такого оксида является оксид натрия (Na2O). Амфотерные оксиды могут проявлять и кислотные, и основные свойства в зависимости от условий реакции. Примером амфотерного оксида является оксид алюминия (Al2O3).
Теоретические основы реакции

При реакции металла с его оксидом происходит химическое превращение, в результате которого образуются новые вещества. Оксид металла выступает в качестве реагента, а металл — в качестве субстрата. Реакция основана на принципах окислительно-восстановительных процессов, где металл подвергается окислению, а оксид металла восстанавливается.
Окислительные реакции обычно сопровождаются изменением энергии связи, что приводит к образованию новых соединений. В случае реакции металла с оксидом, металл передает электроны оксиду, что ведет к образованию металлического элемента и водорода в виде газа.
Важно отметить, что оксиды металлов могут иметь различные степени окисления, что влияет на химические свойства соединений. Для определения эквивалентов металла при реакции с его оксидом необходимо учесть эту информацию и провести необходимые расчеты.
Определение эквивалентов металла является важным шагом при решении задач химического анализа и синтеза. Правильное определение эквивалентных масс металла и оксида металла позволяет правильно расчеты массы реагентов и продуктов, а также установить соотношение между ними.
Выбор подходящего оксида

Для определения эквивалентов металла при реакции с его оксидом необходимо выбрать подходящий оксид, который будет соответствовать реакции, происходящей в данной системе.
Выбор подходящего оксида зависит от ряда факторов, таких как химические свойства металла, его степень окисления и цель данной реакции.
Оксиды металлов делятся на две основные категории: основные и амфотерные. Основные оксиды образуются при взаимодействии металлов с кислородом и обладают восстановительными свойствами. Амфотерные оксиды могут взаимодействовать как с кислотными, так и с основными реагентами.
Для выбора подходящего оксида необходимо учитывать химические свойства металла и реагентов, с которыми он будет взаимодействовать. Например, если требуется окислить металл, то необходимо выбрать оксид, способный взаимодействовать с кислородом и участвовать в окислительной реакции.
Кроме того, следует учитывать степень окисления металла. Некоторые металлы имеют различные степени окисления, поэтому подходящий оксид должен соответствовать степени окисления металла в данной реакции.
Подготовка раствора оксида
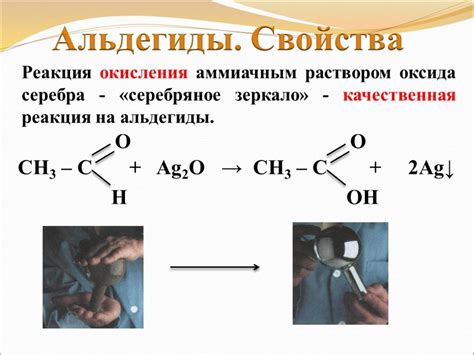
Для вычисления эквивалентов металла при реакции с его оксидом необходимо подготовить раствор оксида. Подготовка раствора начинается с взвешивания определенного количества оксида в соответствии с требуемой концентрацией.
Для достижения равномерного распределения оксида в растворе, его следует тщательно перемешать с растворителем с помощью магнитной мешалки или встряхиванием. Оксид должен полностью раствориться в растворителе, чтобы обеспечить максимальную эффективность реакции с металлом.
После растворения оксида необходимо проверить концентрацию раствора с помощью весов или специальных индикаторов, чтобы убедиться, что требуемые условия для проведения реакции с металлом будут выполнены.
Подготовленный раствор оксида должен быть герметично закрыт и храниться в безопасном месте до момента его использования. Важно следить за соблюдением правил безопасности при работе с оксидом, так как это вещество может быть опасным и вызывать раздражение или другие негативные последствия при контакте с кожей или слизистыми.
Проведение реакции
Для вычисления эквивалентов металла при реакции с его оксидом необходимо правильно провести саму реакцию.
Сначала необходимо взять определенное количество металла и оксида и поместить их в реакционный сосуд. Далее следует обеспечить подходящие условия для протекания реакции. Как правило, это может быть нагревание смеси на протяжении определенного времени или добавление специального катализатора.
При проведении реакции металл и оксид вступают в химическую реакцию, в результате которой происходит образование соответствующего металлического оксида и выделение свободного кислорода.
Далее необходимо определить количество образовавшегося металлического оксида. Для этого можно использовать различные методы анализа, такие как химический анализ или термический анализ. После определения массы металлического оксида можно вычислить количество соединившегося с ним металла.
Результатом проведения реакции будет определение эквивалентного количества металла при реакции с его оксидом. Это позволяет изучать химические свойства металлов и их оксидов, а также проводить определенные расчеты, связанные с использованием этих веществ в различных процессах и технологиях.
Измерение массы и объема реакционных веществ

Измерение массы и объема реакционных веществ является важным этапом в химических экспериментах. Точные измерения массы и объема позволяют получить точные результаты и рассчитать эквиваленты металла при реакции с его оксидом.
Для измерения массы реакционных веществ используются аналитические весы. Они позволяют измерить массу с высокой точностью до миллиграмма. Взвешивание проводят на тарированной плоскости аналитических весов, предварительно установив их на нуль. Таким образом, получается точное значение массы реакционного вещества.
Измерение объема реакционных веществ можно производить с помощью пробирки или мерного сосуда. Для точного измерения объема необходимо учитывать температуру и давление воздуха, так как они могут влиять на объем вещества. Также важно учитывать, что объем реакционного вещества может изменяться при смешивании или растворении с другими веществами.
Для удобства измерения массы и объема реакционных веществ используются различные единицы измерения. Например, для массы часто используется грамм, миллиграмм или микрограмм, а для объема - литр, миллилитр или кубический сантиметр.
Необходимо отметить, что точность измерений массы и объема реакционных веществ играет решающую роль при расчете эквивалентов металла. Поэтому при проведении эксперимента необходимо соблюдать все правила и использовать точные инструменты для измерения.
Вычисление эквивалента металла

Вычисление эквивалента металла является важной задачей при реакции металла с его оксидом. Эквивалент металла определяется как количество металла, которое может образовать один эквивалентные вес оксида металла.
Для вычисления эквивалента металла необходимо знать формулу оксида металла и его молярную массу. Первым шагом является определение молярной массы оксида металла, которая вычисляется путем сложения молярных масс каждого элемента в оксиде. Далее необходимо определить молярную массу металла, которая может быть получена из формулы оксида металла путем выделения металла.
Получив значения молярной массы оксида металла и металла, можно вычислить эквивалент металла, используя соотношение эквивалентов:
эквивалент металла = молярная масса металла / молярная масса оксида металла
Эквивалент металла позволяет определить количество металла, которое участвует в реакции с оксидом металла. Эта информация может быть полезной при расчетах массы металла или оксида металла, а также при определении стехиометрического соотношения в реакции.
Вопрос-ответ

Какие методы существуют для вычисления эквивалентов металла при реакции с его оксидом?
Существуют два основных метода для вычисления эквивалентов металла при реакции с его оксидом: метод радиоактивной меченой тетрациклины и метод титрования.
Расскажите подробнее о методе радиоактивной меченой тетрациклины.
Метод радиоактивной меченой тетрациклины заключается в добавлении определенного количества радиоактивной меченой тетрациклины к реакционной смеси металла и его оксида. Затем с помощью измерительной аппаратуры определяется количество радиоактивной меченой тетрациклины, связанной с металлом. На основе этих данных можно вычислить эквиваленты металла в реакции.
