Атомы металлов обладают рядом характеристик, которые делают их особенными в сравнении с другими элементами. Одной из наиболее заметных особенностей атомов металлов является их способность образовывать положительные ионы путем отдачи электронов. Это происходит благодаря тому, что у атомов металлов на внешнем энергетическом уровне находятся малое количество электронов в сравнении с общим числом электронов в атоме.
Второй характеристикой атомов металлов является их металлическая связь, которая обеспечивается благодаря деликатному балансу между силами притяжения между положительно заряженными ядрами и отдающимися электронами. Благодаря этому балансу атомы металлов способны образовывать металлические сетки, которые обеспечивают металлам и их сплавам такие свойства, как высокая теплопроводность и электропроводность, а также способность к деформации и пластичности.
Также следует отметить, что атомы металлов обладают большими размерами по сравнению с атомами неметаллов. Это объясняется тем, что атомы металлов имеют более слабое притяжение между ядром и внешним энергетическим уровнем, что в свою очередь обусловливает больший радиус ионизации.
В целом, характеристики атомов металлов определяют их уникальные свойства и важность в различных отраслях промышленности и науке. Понимание этих характеристик позволяет лучше понять поведение и взаимодействие металлов с другими элементами, а также использовать их в различных технологических процессах и материалах.
Атомы металлов обладают высокой плотностью
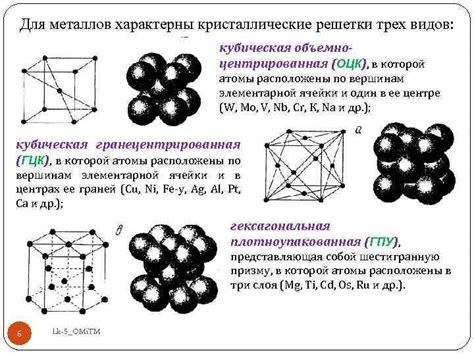
Атомы металлов отличаются высокой плотностью, которая является одним из их характерных свойств. Плотность атомов металлов обусловлена их структурой и взаимодействием между отдельными атомами.
В основном, атомы металлов имеют компактную структуру, в которой они тесно упакованы друг к другу. Это объясняет высокий уровень плотности, так как большое количество атомов занимает относительно небольшой объем.
Высокая плотность атомов металлов обусловливает их физические свойства, такие как твердость и прочность. Благодаря плотной упаковке атомов, металлы обладают высокой механической прочностью и способностью выдерживать большие нагрузки.
Плотность атомов металлов также влияет на электрические и тепловые свойства. Высокая плотность позволяет электронам свободно двигаться между атомами, что обуславливает хорошую электропроводность металлов. Также, благодаря высокой плотности атомов, металлы обладают высокой теплопроводностью.
В целом, высокая плотность атомов металлов является одним из фундаментальных характеристик, определяющих их физические и химические свойства. Это позволяет металлам быть широко использованными в различных областях промышленности и технологии.
Атомы металлов имеют низкую ионизационную энергию

Ионизационная энергия - это энергия, необходимая для удаления одного электрона из атома. У металлов эта энергия обычно низкая, что объясняет их склонность к образованию положительных ионов.
Металлы обладают малым количеством электронов во внешней оболочке, что делает процесс удаления электрона относительно легким. В связи с этим, атомы металлов более склонны к ионизации, чем атомы неметаллов, у которых более высокая ионизационная энергия.
Низкая ионизационная энергия атомов металлов также обуславливает их способность образовывать положительные ионы, которые имеют химическую активность в реакциях соединения. Это позволяет металлам проявлять свойства, такие как теплопроводность, электропроводность и пластичность.
Таким образом, низкая ионизационная энергия является важной характеристикой атомов металлов, которая определяет их химическую активность и способность образовывать положительные ионы.
Атомы металлов образуют положительные ионы

Одной из характеристик атомов металлов является их способность образовывать положительные ионы. Это связано с особенностями строения атомов металлов и их электронной структуры.
Атом металла состоит из ядра, которое содержит положительно заряженные протоны, и электронной оболочки, в которой находятся отрицательно заряженные электроны. Количество протонов в ядре определяет заряд ядра, а количество электронов в оболочке обычно равно количеству протонов, что делает атом электрически нейтральным.
Однако, атомы металлов имеют свойство отделять от своей электронной оболочки один или несколько электронов, превращаясь в положительно заряженные ионы. Это происходит в результате процесса ионизации, когда металлический атом теряет один или несколько своих электронов. Таким образом, атомы металлов образуют ионы, имеющие положительный заряд.
Потеря электронов приводит к образованию ионов, у которых количество протонов в ядре превышает количество электронов на одну или несколько единиц. В результате атом приобретает положительный заряд, который соответствует количеству отдельно существующих электронов и вызывает обычно меньшие размеры ионов по сравнению с электрически нейтральными атомами.
Атомы металлов обладают высокой электропроводностью

Электропроводность является одним из основных характеристик атомов металлов. Она определяет способность материала проводить электрический ток. Металлы характеризуются высокой электропроводностью, что делает их ценными материалами для использования в различных электронных устройствах, проводах и контактах.
У атомов металлов электропроводность обусловлена специфической структурой электронной оболочки. Внешние электроны металлических атомов образуют так называемый электронный газ, который легко передвигается в материале под действием электрического поля. Этот свободный движок электронов позволяет металлам быть отличными проводниками электричества.
Металлическая структура атомов обеспечивает высокую электропроводность благодаря явлению металлической связи. В металлах атомы объединены в регулярную кристаллическую решетку, где положительно заряженные атомы являются ядрами катионов, а свободные электроны заполняют пространство между ними. Электроны в металлической связи равномерно распределены по всей структуре и могут свободно перемещаться, обеспечивая передачу электрического тока через материал.
Металлическая электропроводность имеет широкое применение в различных областях, таких как производство электроники, электрометаллургия, энергетика и многие другие. Благодаря своей высокой электропроводности, атомы металлов играют важную роль в современных технологиях и обеспечивают эффективную передачу электрической энергии.
Атомы металлов имеют малое количество валентных электронов
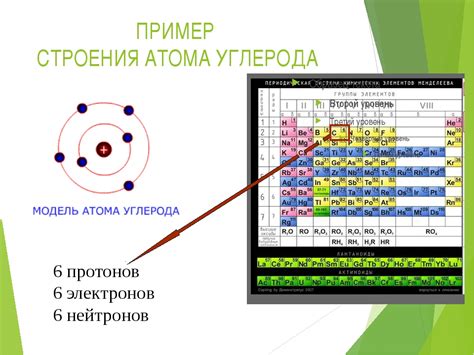
Одной из характеристик атомов металлов является их отличие по количеству валентных электронов от атомов других элементов. Валентными электронами называются электроны, находящиеся на самой внешней энергетической оболочке атома.
Валентные электроны играют важную роль в химических свойствах атомов. Именно количество и расположение валентных электронов определяет возможность образования химических связей между атомами и, следовательно, влияет на химическую активность элемента.
Атомы металлов характеризуются малым количеством валентных электронов. К примеру, валентные электроны меди (Cu) находятся на семье оболочке и их всего один. Подобно меди, атомы других металлов обычно обладают 1, 2 или несколькими валентными электронами.
Малое количество валентных электронов обуславливает высокую химическую активность металлов. Они стремятся заключать химические связи, чтобы достичь электронной конфигурации инертного газа. Металлы активно реагируют с неметаллами, чтобы образовать ионные соединения, а также могут образовывать связи между атомами того же металла в металлических структурах.
Атомы металлов имеют высокую теплопроводность

Атомы металлов обладают способностью быстро передавать тепло в своей решетке, что объясняет их высокую теплопроводность. Это свойство металлов делает их незаменимыми во многих отраслях промышленности, где требуется эффективное распределение тепла.
Высокая теплопроводность атомов металлов обусловлена особенностями их электронной структуры. Атомы металлов имеют небольшую энергию ионизации, что означает, что их электроны могут легко перемещаться по структуре металла. Это создает условия для быстрого распространения тепла через весь материал.
Благодаря высокой теплопроводности атомов металлов, такие материалы, как медь или алюминий, применяются в различных системах охлаждения, теплообменных установках и термических средах. Их способность эффективно передавать тепло помогает поддерживать оптимальные температурные режимы в различных процессах и обеспечивает эффективность работы систем.
Атомы металлов обладают металлическим блеском
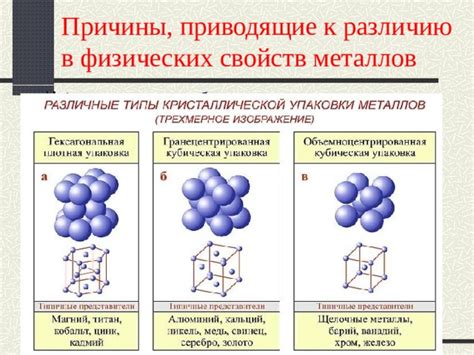
Металлы - это группа элементов, характеризующихся определенными свойствами. Одно из таких свойств - металлический блеск, который проявляется благодаря особенностям структуры атомов металлов.
Атомы металлов обладают особым строением, отличным от строения атомов неметаллических элементов. У них внешняя электронная оболочка состоит из малого числа электронов, что делает их легкими потерять или отдать электроны другим атомам.
Главная причина металлического блеска заключается в так называемом свободном движении электронов. Атомы металлов образуют кристаллическую решетку, в которой электроны свободно движутся между атомами, создавая эффект отражения света. Благодаря этому, металлы имеют характерный металлический блеск при освещении.
Металлический блеск может быть различной интенсивности и оттенка, что зависит от конкретных свойств металла и его поверхности. Он может быть ярким и зернистым, холодным или теплым, но всегда это свойство является специфичным и неповторимым для атомов металлов.
Вопрос-ответ

Какие физические характеристики атомов металлов имеются в виду?
Физические характеристики атомов металлов включают такие параметры, как радиус, электронную конфигурацию и поляризуемость. Эти характеристики определяют множество свойств металлов, включая их электропроводность, теплопроводность и магнитные свойства.
Какой радиус имеют атомы металлов?
Радиус атомов металлов обычно находится в диапазоне от 0,12 до 0,34 нанометров. Он зависит от типа и химической природы металла. Например, у щелочных металлов радиусы атомов меньше, чем у переходных металлов.
Какая электронная конфигурация характерна для атомов металлов?
Атомы металлов обычно имеют электронную конфигурацию, основанную на заполнении энергетических уровней s и p. Некоторые металлы также могут иметь электроны на d-или f-уровнях. Количество электронов в этих уровнях может варьироваться в зависимости от вида металла.
Что такое поляризуемость атомов металлов?
Поляризуемость атома металла - это его способность деформироваться под воздействием электрического поля. Это свойство определяется электронной оболочкой атома и его радиусом. Чем больше поляризуемость атома металла, тем легче он может претерпевать деформацию и образовывать ионные связи.
Какие свойства металлов зависят от характеристик их атомов?
Характеристики атомов металлов, такие как радиус, электронная конфигурация и поляризуемость, определяют множество свойств металлов. Например, радиус атомов влияет на плотность металла и его межатомные взаимодействия. Электронная конфигурация определяет электропроводность и теплопроводность металлов. Поляризуемость влияет на способность металлов образовывать ионные связи и реагировать с другими веществами.
