Металлы, оксиды которых образуют щелочную реакцию при взаимодействии с водой, являются одной из важных групп элементов в химии. Эти металлы имеют способность образовывать основания, в результате чего вода приобретает свойства щелочного раствора.
Первым металлом, который образует щелочную реакцию при взаимодействии с водой, является натрий. Он принадлежит к группе щелочных металлов и является одним из самых распространенных элементов в природе. Оксид натрия (Na2O) образует щелочную реакцию с водой, растворяясь и превращаясь в гидроксид натрия (NaOH).
Еще одним металлом этой группы является калий. Оксид калия (K2O) также образует щелочную реакцию с водой, превращаясь в гидроксид калия (KOH). Калий является неотъемлемой частью нашего питания, так как входит в состав многих продуктов и солей.
Кроме натрия и калия, к щелочным металлам также относятся литий и цезий. Литий имеет свойство реагировать с водой, образуя гидроксид лития (LiOH). Цезий, самый легкий из щелочных металлов, образует также гидроксид цезия (CsOH) при контакте с водой.
Металлы, образующие щелочную реакцию при взаимодействии с водой

В химии существует группа металлов, которые образуют щелочные растворы при взаимодействии с водой. Данный процесс называется гидролизом, при котором образуются гидроксиды и выделяется водород.
Одним из примеров таких металлов является калий (K), который при погружении в воду быстро реагирует, образуя щелочной раствор и искры. Калийный гидроксид (KOH) получается в результате этой реакции и обладает амфотерными свойствами.
Еще одним примером металла, образующего щелочную реакцию с водой, является натрий (Na). Подобно калию, натрий реагирует с водой, образуя натриевый гидроксид (NaOH). Натриевая гидроксидная щелочь широко используется в промышленности, в производстве мыла и других щелочных продуктов.
Еще одним металлом, образующим щелочную реакцию при взаимодействии с водой, является кальций (Ca). В результате гидролиза кальция получается кальциевый гидроксид (Ca(OH)2), который является сильной щелочью и использование в различных отраслях промышленности, включая строительство и производство цемента.
Таким образом, металлы, образующие щелочную реакцию при взаимодействии с водой, играют важную роль в химической промышленности и научных исследованиях. Гидроксиды этих металлов широко применяются в различных сферах, начиная от производства щелочных продуктов до использования в фармацевтике и сельском хозяйстве.
Щелочные металлы
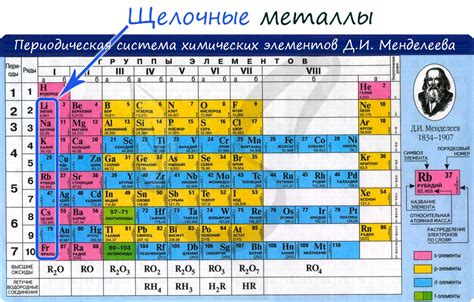
Щелочные металлы - это химические элементы, которые образуют щелочные реакции при взаимодействии с водой. В периодической системе элементов, щелочные металлы расположены в первой группе, и включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Щелочные металлы обладают высокой активностью и химической реакционностью, что проявляется в их способности растворяться в воде с образованием щелочных растворов. При этом происходит выделение водорода. Например, реакция натрия с водой:
2Na + 2H2O → 2NaOH + H2
Щелочные металлы хранятся под слоем пара, так как они очень реактивны и подвержены окислению. Они имеют низкую плотность и низкую точку плавления. Большинство щелочных металлов имеют серебристо-белый цвет и мягкие свойства.
Щелочные металлы имеют широкое применение в различных областях. Например, натрий используется в производстве соды, стекла и металлов. Калий применяется в производстве удобрений, а также в производстве стекла и мыла. Литий используется в батарейках и в производстве лекарственных препаратов для биполярного расстройства.
Однако, взаимодействие щелочных металлов с водой является очень экзотическим явлением и может сопровождаться химическими реакциями, которые проходят с большим выделением тепла и образованием пламени. Поэтому, взаимодействие с щелочными металлами требует особой осторожности и безопасности.
Переходные металлы

Переходные металлы - это элементы, расположенные в центре периодической таблицы. Они обладают высокой термической и электрической проводимостью, а также имеют разнообразные физические и химические свойства. Взаимодействие переходных металлов с водой обычно не приводит к образованию щелочной реакции.
Лантаноиды и актиноиды также являются переходными металлами. Они характеризуются сходными свойствами, но их специфические химические реакции могут отличаться от основных переходных металлов.
Некоторые переходные металлы, такие как цирконий, титан и ванадий, образуют оксиды, которые обладают кислыми свойствами при взаимодействии с водой. Однако это отклонение от типичного поведения переходных металлов и связано с особыми особенностями их электронной структуры.
Общие химические свойства переходных металлов включают способность образовывать разнообразные соединения, образование комплексных соединений с органическими и неорганическими лигандами, высокую каталитическую активность и возможность принимать различные степени окисления.
Изучение переходных металлов имеет большое значение для разработки новых материалов, катализаторов и многих других применений в химической промышленности и технологии.
Лантаноиды и актиноиды
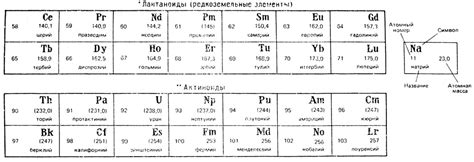
Лантаноиды - это серия химических элементов, которые располагаются в периодической системе элементов под лантаном. Они относятся к категории редкоземельных металлов и имеют схожие химические свойства. Лантаноиды включают элементы от лантана (La) до лутеция (Lu) и имеют атомные номера от 57 до 71.
Актиноиды - это серия химических элементов, которые располагаются в периодической системе элементов под актинием. Они также относятся к категории редкоземельных металлов и имеют схожие химические свойства. Актиноиды включают элементы от актиния (Ac) до лоуренсия (Lr) и имеют атомные номера от 89 до 103.
Лантаноиды и актиноиды обладают свойством образования оксидов, которые образуют щелочную реакцию при взаимодействии с водой. Это связано с наличием незаполненных f-электронных оболочек у данных элементов, что приводит к особенностям их химического поведения.
Одной из особенностей лантаноидов и актиноидов является их способность образовывать стабильные и растворимые соединения. Некоторые из этих соединений широко используются в различных технологических и промышленных процессах.
Лантаноиды и актиноиды также отличаются высокой радиоактивностью некоторых их изотопов, что делает их важными для медицинских и научных исследований, а также для производства радиоизотопов для различных целей.
Редкоземельные металлы

Редкоземельные металлы – это группа химических элементов, расположенных в таблице Менделеева после лантана и актиния. Они включают 17 элементов, включая скандий, иттрий и все элементы серии лантана.
Редкоземельные металлы имеют широкий спектр применения в различных отраслях промышленности. Они используются в производстве магнитов, катализаторов, ламп накаливания, лазеров, батарей и других электронных устройств.
Большинство редкоземельных металлов обладает высокой химической активностью и реактивностью. Например, самарий и европий входят в состав фосфоресцентных материалов, которые активируются при воздействии на них ультрафиолетового света.
При взаимодействии с водой редкоземельные металлы также могут образовывать щелочную реакцию. Например, щелочная реакция наблюдается при растворении гадолиния Gd в воде.
Редкоземельные металлы играют важную роль в современных технологиях и находят применение в различных отраслях науки и промышленности.
Вопрос-ответ

Какие металлы образуют щелочную реакцию при взаимодействии с водой?
Металлы, которые образуют щелочную реакцию при взаимодействии с водой, включают натрий (Na), калий (K), литий (Li) и цезий (Cs).
Почему щелочные металлы образуют щелочную реакцию с водой?
Щелочные металлы имеют низкую электроотрицательность и низкую энергию ионизации, что делает их более реакционноспособными. При контакте с водой, металлы реагируют с водой, образуя гидроксиды и выделяя водород. Гидроксиды щелочных металлов обладают щелочными свойствами, и поэтому реакция образует щелочную среду.
Как происходит реакция щелочных металлов с водой?
При взаимодействии щелочных металлов (натрия, калия, лития и цезия) с водой происходит реакция, в результате которой образуются гидроксиды металлов (NaOH, KOH, LiOH, CsOH) и выделяется водородный газ (H2). Реакция происходит с выделением тепла и образованием щелочной среды.
Какова химическая формула гидроксида натрия?
Химическая формула гидроксида натрия - NaOH. Это щелочное соединение, образующееся при взаимодействии натрия с водой.
Какую роль играют щелочные растворы в химических реакциях?
Щелочные растворы имеют важное значение в химических реакциях. Они могут использоваться в качестве реагентов и катализаторов, участвовать в нейтрализации кислот или служить ионными растворителями для различных соединений. Также щелочные растворы могут использоваться в бытовых и промышленных целях, например, для мытья, очистки и обезжиривания поверхностей.
