Растворимость солей металла является важным и интересным вопросом в области химии и материаловедения. Возможность солей металла растворяться в различных растворителях существенно влияет на их применение в различных отраслях промышленности и науки.
Существует общепринятый миф о том, что все соли металла могут растворяться в воде. Однако, это не совсем верно. Фактически, растворимость солей металла зависит от их химической структуры и взаимодействия с растворителем.
Взаимодействие солей металла с растворителем обусловлено характером электрических зарядов и положением элемента в периодической системе. Некоторые соли металла, такие как хлорид натрия и сульфат магния, обладают высокой растворимостью в воде и легко диссоциируют на ионы. Однако, существуют и такие соли, как карбонат кальция или оксид железа, которые плохо растворяются в воде и образуют осадок.
Свойства растворимости солей металла: изучаем миф или реальность?
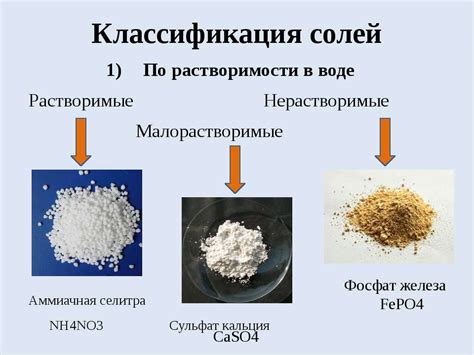
Растворимость солей металлов - одно из важнейших свойств, которое интересует многих исследователей и производителей. Миф или реальность - это вопрос, который требует глубокого анализа и экспериментального подтверждения.
Соли металлов, являясь химическими соединениями, имеют разную степень растворимости в воде и других растворителях. Однако, наличие металла в составе соли влияет на его растворимость. Существует ряд металлов, чьи соли обладают высокой растворимостью, например, натрий, калий, аммоний. В то же время, есть металлы, чьи соли малорастворимы, например, серебро, медь, свинец.
Однако, свойства растворимости солей металла могут зависеть от различных факторов, таких как температура, давление, концентрация других веществ в растворе. Они могут быть различными и для разных солей одного и того же металла. Таким образом, изучение растворимости солей металлов требует тщательного исследования и проведения экспериментов.
Существует несколько методов изучения растворимости солей металлов, таких как определение растворимости по видимости раствора, измерение теплоты растворения, проведение химических реакций с тестовыми реагентами. Эти методы позволяют получить точные данные о растворимости солей металлов и определить их факт или миф.
В целом, свойства растворимости солей металлов являются реальностью и зависят от множества факторов. Дальнейшие исследования и эксперименты помогут более подробно изучить эту тему и расширить наши знания в области химии.
Что такое растворимость солей металла?
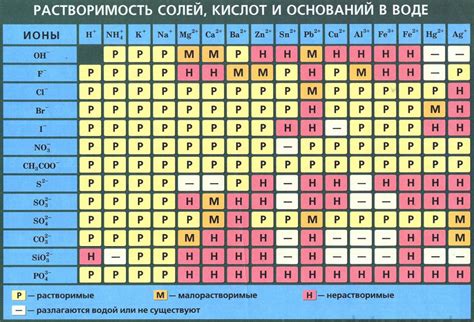
Растворимость солей металла – это способность солей металла растворяться в определенной жидкости или растворе. Она определяет, насколько эффективно соль может переходить из твердого состояния в растворенное состояние. Растворимость солей металла может быть разной для разных соединений и зависит от ряда факторов, таких как температура, концентрация раствора и химическая природа реагирующих веществ.
Исследование растворимости солей металла имеет значительное практическое значение, особенно в области химической промышленности и научных исследований. Понимание растворимости солей металла позволяет контролировать процессы осаждения и кристаллизации, а также разрабатывать новые материалы и реагенты с определенными свойствами.
Помимо этого, растворимость солей металла играет важную роль в биохимии и медицине. Многие химические реакции в организме, такие как ферментативные процессы или перенос ионов через мембраны, зависят от растворимости солей металла. Изучение этой сферы позволяет понять взаимодействие между биологическими системами и химическими элементами и использовать данную информацию в различных лечебных или пищеварительных целях.
Влияние факторов на растворимость солей металла
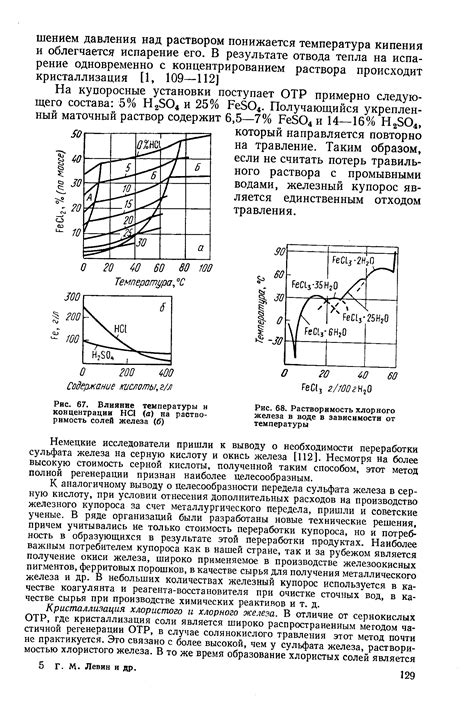
Температура: Одним из основных факторов, влияющих на растворимость солей металла, является температура. Обычно, при повышении температуры, растворимость солей металла увеличивается. Это объясняется тем, что при повышении температуры, возрастает энергия частиц, что способствует разрушению кристаллической решетки соли и увеличению межмолекулярного пространства, в котором могут перемещаться молекулы растворителя и ионы соли.
Растворитель: Выбор растворителя также оказывает существенное влияние на растворимость солей металла. Растворимость солей может значительно отличаться в различных растворителях. Это объясняется различными химическими взаимодействиями молекул соли и молекул растворителя, а также различной полярностью и растворностью самих растворителей.
Давление: Давление прямо не влияет на растворимость солей металла, поскольку соли в растворе находятся в ионной, а не молекулярной форме. Однако, изменение давления может оказывать влияние на растворимость газообразных солей. При повышении давления, растворимость таких солей увеличивается, так как имеется больше газа, способного раствориться в жидкости.
Вид ионов: Вид ионов, которые образуются при диссоциации солей металла, также может влиять на их растворимость. Некоторые ионы могут образовывать сильные химические связи с молекулами растворителя, что делает их более растворимыми. Однако, существуют и ионы, которые образуют слабые связи с растворителем и поэтому проявляют меньшую растворимость.
Еще несколько факторов, влияющих на растворимость солей металла:
- Растворимость может зависеть от наличия других растворенных ионов, которые могут образовывать осадок или сложные соединения с солями металла.
- Растворимость солей может изменяться в зависимости от pH среды, так как ионы металла могут образовывать ионы гидроксида или других комплексных соединений в избыточной щелочной или кислотной среде.
- Наличие других веществ, таких как примеси, могут оказывать влияние на растворимость солей металла, образуя новые химические соединения или взаимодействуя с ионами соли.
Таким образом, растворимость солей металла зависит от множества факторов, таких как температура, растворитель, давление и вид ионов. Изучение и понимание этих факторов позволяют контролировать и предсказывать растворимость солей металла в различных условиях.
Зависимость растворимости от структуры соли
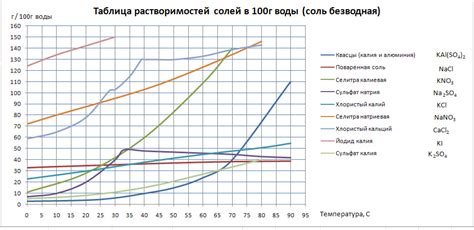
Растворимость солей металлов зависит от их структуры. Возможность соли растворяться в воде или других растворителях определяется наличием свободных ионов в решетке кристаллической структуры соли.
Кристаллическая структура солей может быть различной, включая ионные, ковалентные и металлические связи. В ионных соединениях, например, натриевых или калиевых солях, положительные ионы (катионы) и отрицательные ионы (анионы) образуют решетку, в которой ионы окружены ионами противоположного заряда.
Растворимость ионных солей зависит от силы связей между ионами в решетке. Если связи слабы, то ионы могут легко отделяться и растворяться в воде, образуя ионный раствор. Если связи крепкие, то соль будет слабо растворима. Например, хлорид натрия (NaCl) хорошо растворяется в воде, так как решетка соли легко разрушается, а хлорид серебра (AgCl) плохо растворим, так как его решетка очень прочная.
Ковалентные соединения, такие как хлорид кремния (SiCl4), имеют молекулярные структуры, где атомы связаны общими электронными парами. Такие соединения обычно плохо растворяются в воде, так как для их растворения необходимо разорвать ковалентные связи. Однако, у некоторых ковалентных соединений встречается разные структуры с разной растворимостью.
Металлические соли, например, сульфат железа (FeSO4), обладают сложной структурой, состоящей из положительного металлического ядра и отрицательных ионов. Растворимость таких солей может быть разной в зависимости от химического окружения и условий.
Методы измерения растворимости солей металла
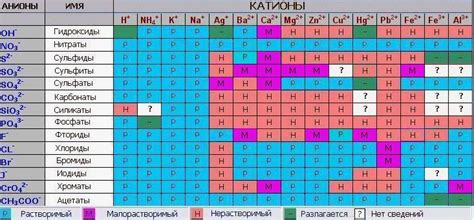
Измерение растворимости солей металла является важной задачей в химии. Существует несколько методов, которые позволяют определить степень растворимости солей металла в воде или других растворителях.
Один из самых распространенных методов - гравиметрическое измерение. При использовании этого метода, производится тщательное взвешивание определенного количества соли металла перед и после ее растворения. Разница в массе позволяет определить степень растворимости соли.
Еще одним методом измерения растворимости солей металла является визуальное наблюдение. При данном методе, производится наблюдение за изменением цвета или прозрачности раствора. Этот метод особенно эффективен, когда соль образует видимые осадки при ее нерастворении.
Другой способ измерения растворимости солей металла - потенциометрическое измерение. При данном методе, используется потенциометр для измерения изменения электрического потенциала раствора при добавлении соли металла. Изменение потенциала позволяет определить степень ионизации и, следовательно, растворимость соли.
Также можно воспользоваться методом выпадения осадка. При данном методе, измеряется количество осадка, образующегося при добавлении определенного количества соли металла в воду или другой растворитель. По количеству осадка можно судить о растворимости соли.
Наконец, существует метод кондуктометрического измерения растворимости солей металла. При данном методе, измеряется электропроводность раствора при различных концентрациях соли. Изменение электропроводности позволяет определить степень растворимости соли металла.
Практическое применение растворимости солей металла

Растворимость солей металла имеет важное практическое применение в различных сферах науки и промышленности. Одним из ключевых аспектов применения растворимости солей является ее роль в химическом анализе. Путем растворения солей металла и последующего их идентификации и количественного определения можно определить состав и концентрацию различных веществ в образцах.
Растворимость солей металла также имеет важное значение в фармацевтической и медицинской промышленности. Многие лекарственные препараты и добавки содержат вещества, полученные из растворимых солей металлов. Эти соли могут использоваться для улучшения стабильности, растворимости и биодоступности лекарственных веществ, что в свою очередь способствует их эффективному и безопасному использованию.
Еще одной областью, где применяется растворимость солей металлов, является производство разных материалов. Например, для получения покрытий используются растворимые соли металлов, которые после нанесения на поверхность обрабатываются с целью получения требуемых физических и химических свойств. Также, растворимые соли металлов могут быть использованы в процессе синтеза материалов с желаемыми свойствами, например, для получения катализаторов или электронных компонентов.
Поэтому, практическое применение растворимости солей металла находится во многих областях науки и промышленности, включая химический анализ, фармацевтику, медицину и производство различных материалов. Использование растворимых солей металлов в этих областях позволяет существенно улучшить эффективность и качество процессов и продуктов, а также способствует разработке новых технологий и материалов.
Вопрос-ответ

Что такое растворимость солей металлов?
Растворимость солей металлов - это способность солей металлов растворяться в определенном растворителе, образуя раствор.
Все соли металлов растворимы в воде?
Нет, не все соли металлов растворимы в воде. Растворимость солей металлов в воде зависит от многих факторов, таких как температура, концентрация и свойства растворителя.
Какие факторы влияют на растворимость солей металлов?
Факторы, которые влияют на растворимость солей металлов, включают температуру, концентрацию соли и свойства растворителя. Высокая температура и низкая концентрация соли обычно повышают растворимость солей металлов.
Можно ли предсказать растворимость соли металла?
Да, в некоторых случаях можно предсказать растворимость соли металла. Например, если известны растворимости солей металлов в других растворителях или при разных температурах, можно сделать предположение о растворимости в воде.
Какая соль металла самая растворимая?
Самая растворимая соль металла зависит от конкретного металла и растворителя. Например, нитрат калия (KNO3) является одной из самых растворимых солей металлов в воде.
