Щелочные металлы - это группа элементов периодической системы, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе таблицы, что означает, что у них один электрон во внешней оболочке.
Замечательной особенностью щелочных металлов является их высокая реактивность. Они реагируют с водой, выделяя водород и образуя щелочные растворы. Эта реактивность делает их полезными в различных процессах, таких как производство щелочей, сплавов, лекарств и др.
Одним из интересных свойств щелочных металлов является их способность образовывать ионы с положительным зарядом. Например, литий образует ион Li+, натрий – Na+, калий – K+, и так далее. Ионы щелочных металлов играют важную роль в процессе передачи нервных импульсов в организмах живых существ. Они также влияют на различные физиологические процессы и позволяют сбалансировать электрический заряд в клетках.
Перечень щелочных металлов и их особенности

Щелочные металлы - это элементы, которые относятся к первой группе периодической системе химических элементов. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы имеют низкую плотность, низкую температуру плавления и кипения, и хорошую проводимость электричества и тепла.
Щелочные металлы обладают реактивной химической активностью из-за своей низкой ионизационной энергии и хорошей положительной зарядом ядра. Они быстро реагируют с кислородом воздуха и водой, образуя оксиды и гидроксиды. Эти реакции являются экзотермическими, то есть сопровождаются выделением тепла.
Одной из особенностей щелочных металлов является их способность образовывать ионы +1 заряда. Это связано с тем, что у них всего одна электронная оболочка, которая легко отдаётся в химических реакциях. В основном щелочные металлы образуют ионы растворимых солей, имеющие ярко выраженный цвет.
Еще одной важной особенностью щелочных металлов является их способность образовывать легкорастворимые гидроксиды, которые обычно представляют собой сильные щелочи. Поэтому щелочные металлы и их соединения широко используются в промышленности, в процессе производства стекла, мыла, щелочных аккумуляторов, продуктов питания и других химических продуктов.
Таким образом, щелочные металлы играют важную роль в нашей жизни, благодаря своим химическим и физическим свойствам. Они являются ключевыми элементами в различных отраслях промышленности и научных исследованиях, и продолжают привлекать внимание ученых и инженеров своими уникальными характеристиками.
Свойства щелочных металлов

Щелочные металлы - это группа элементов периодической системы, которые относятся к первой группе. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Основное свойство щелочных металлов - их высокая реактивность. Они являются одними из самых реактивных металлов на Земле и активно взаимодействуют с водой, кислородом и большинством неметаллов. Поэтому они обычно хранятся в среде без кислорода, такой как минеральное масло.
Щелочные металлы хорошо проводят электричество и тепло, что делает их полезными материалами в электронике и различных технических приложениях. Например, натрий используется в производстве стекла, а калий - в удобрениях для растений.
Они обладают низкой плотностью, что делает их легкими и подвижными. Также у них низкая точка плавления, что позволяет легко перерабатывать их в различные формы. Например, литий используется в производстве легких аккумуляторов.
Щелочные металлы образуют особые соединения, называемые щелочными гидроксидами, которые обладают высокой щелочностью. Они используются в производстве щелочных батарей, мыле и других химических продуктах.
Некоторые из свойств щелочных металлов могут быть опасными. Например, они реагируют с водой, образуя горючий водород, и могут приводить к пожарам и взрывам. Поэтому при работе с щелочными металлами необходимо соблюдать особые меры безопасности.
Химические реакции с водой

Щелочные металлы обладают способностью активно реагировать с водой, что делает их ещё более интересными для изучения. При контакте с водой щелочные металлы вступают в химическую реакцию, которая может сопровождаться выделением водорода и образованием щелочи.
Наиболее яркий пример химической реакции щелочного металла с водой можно наблюдать при взаимодействии натрия. При погружении экспериментатором кусочка натрия в воду, происходит вспышка света и возгорание металла. При этом образуется щелочная соль и выделяется водородный газ.
Аналогичные реакции могут происходить и с другими щелочными металлами, такими как калий и литий. Однако, при взаимодействии с водой данных металлов не наблюдается такого яркого эффекта, как в случае с натрием. Это связано с разными реакционными способностями металлов в серии щелочных металлов.
Химические реакции щелочных металлов с водой могут быть использованы в различных областях. Знание этих реакций имеет важное практическое значение для производства мыла, алкоголей, соды и других продуктов домашней химии.
Реакции с кислородом
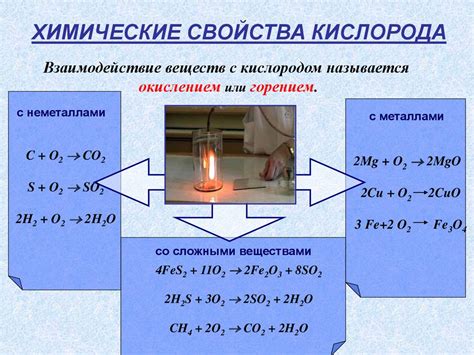
Щелочные металлы активно реагируют с кислородом, образуя оксиды. Эти реакции термические и сопровождаются выделением значительного количества тепла. Наиболее интенсивная реакция наблюдается с цезием и францием, которые горят в кислороде с ярким пламенем.
С помощью кислорода можно получать оксиды щелочных металлов. Например, в реакции натрия с кислородом образуется оксид натрия:
4Na + O2 → 2Na2O
Взаимодействие кислорода с калием и рубидием также приводит к образованию соответствующих оксидов:
- 4K + O2 → 2K2O
- 2Rb + O2 → 2RbO
Полученные оксиды щелочных металлов обладают щелочными свойствами и растворяются в воде, образуя щелочи. Они также могут реагировать с кислотами, образуя соли и воду.
Реакции щелочных металлов с кислородом широко применяются в промышленности и научных исследованиях. Оксиды натрия, калия и других щелочных металлов используются как катализаторы в различных химических процессах.
Влияние щелочных металлов на организм человека

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, играют важную роль в организме человека и необходимы для его нормального функционирования. Однако их превышенное или недостаточное содержание может иметь негативное влияние на организм, вызывая различные заболевания и состояния.
Натрий и калий участвуют в поддержании водно-солевого баланса в организме и регулируют работу мышц и нервной системы. Недостаток натрия может привести к снижению артериального давления, слабости и судорогам, а избыток – к отекам и повышению давления. Недостаток калия может вызвать мышечные судороги, а избыток – нарушения работы сердца.
Литий используется как лекарственное средство при биполярном аффективном расстройстве. Он уравновешивает настроение, уменьшает острые фазы мании и предотвращает депрессию. При недостатке лития у человека могут возникнуть нарушения психического состояния, а его избыток может вызвать отравление.
Рубидий и цезий в небольших количествах присутствуют в пищевых продуктах и влияют на обменные процессы в организме. Их избыток может негативно сказаться на функционировании щитовидной железы и на состоянии сердечно-сосудистой системы.
Выводящиеся из организма через пот и мочу, щелочные металлы могут быть как полезными, так и токсичными, в зависимости от их содержания. Поэтому важно поддерживать баланс этих веществ и учитывать их влияние на организм при составлении рациона питания и применении лекарственных препаратов.
Применение щелочных металлов в промышленности

Литий является одним из самых важных щелочных металлов, используемых в промышленности. Он широко применяется в производстве аккумуляторов, особенно в мобильных устройствах, таких как смартфоны и ноутбуки. Литий также используется в производстве стекла, керамики и алюминия, а также в ядерной энергетике.
Натрий играет важную роль в производстве стекла и щелочи. Он используется в процессе производства значительного количества продуктов питания и напитков, таких как шоколад, сыр и пиво. Натрий также применяется в металлургической, химической и фармацевтической отраслях промышленности.
Калий является важным элементом в сельском хозяйстве, так как он является основным компонентом многих удобрений. Он также используется в производстве стекла, мыла, мочегонных средств и специальных калийных солей для различных промышленных процессов.
Рубидий и цезий имеют ограниченное применение в промышленности. Они используются в оптике и лазерной технологии, радиоизотопной терапии и некоторых электронных устройствах. Несмотря на то, что их использование ограничено, эти металлы все равно играют значительную роль в различных процессах и технологиях.
В целом, щелочные металлы имеют широкий спектр применений в различных отраслях промышленности. Их свойства и химические реакции делают их полезными для создания различных продуктов и материалов, их высокая реактивность способствует эффективности многих производственных процессов.
Охрана окружающей среды при использовании щелочных металлов

Щелочные металлы, такие как литий, натрий и калий, широко используются в различных областях человеческой деятельности. Однако их использование может иметь негативные последствия для окружающей среды, если не принимать необходимые меры охраны.
Во-первых, при хранении щелочных металлов необходимо предусмотреть специальные условия, так как они очень реактивны и могут поддерживать горение при контакте с воздухом или водой. Хранение должно осуществляться в герметичных контейнерах или в вакуумных условиях, чтобы исключить возможность взаимодействия с окружающей средой.
Во-вторых, при использовании щелочных металлов необходимо предусмотреть систему сбора и переработки отходов. Химические реакции и процессы, в которых участвуют щелочные металлы, могут образовывать различные отходы, которые необходимо утилизировать в соответствии с экологическими требованиями. Рециклинг металлов также имеет большое значение с точки зрения экологии, поскольку позволяет минимизировать потребление природных ресурсов и сократить выбросы вредных веществ.
Наконец, важным аспектом охраны окружающей среды при использовании щелочных металлов является предотвращение засорения водных ресурсов. Отработанные батарейки и аккумуляторы, содержащие щелочные металлы, должны быть собраны и утилизированы соответствующим образом, чтобы не попасть в почву или воду. Использование альтернативных источников энергии, таких как солнечные батареи или ветрогенераторы, также способствует снижению вредных воздействий на окружающую среду.
Вопрос-ответ

Какие элементы входят в список щелочных металлов?
Список щелочных металлов включает элементы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Каковы особенности щелочных металлов?
Основные особенности щелочных металлов: низкая плотность, низкий плавящийся точка, высокая реактивность с водой и кислородом, образование гидроксидов, образование ионов с положительным зарядом.
