Щелочные металлы являются группой элементов, которые находятся в первой группе периодической системы. Эта группа включает литий, натрий, калий, рубидий, цезий и франций. У всех щелочных металлов имеется общая особенность - на их внешнем энергетическом уровне находится всего лишь один электрон.
Одноэлектронная структура внешнего энергетического уровня щелочных металлов имеет значительное значение для их химических свойств и реактивности. Этот электрон на внешнем уровне называется валентным электроном. В химических реакциях и ионизации валентный электрон щелочного металла играет важную роль и может легко вступать в связь с другими атомами.
Основная причина, по которой внешний энергетический уровень щелочных металлов имеет всего один валентный электрон, заключается в их электронной конфигурации. Она определяется расположением электронов на энергетических уровнях и подуровнях в атоме. У всех щелочных металлов внешняя электронная оболочка содержит только одну с десятью электронами. Остальные электроны заполняют более низкие энергетические уровни и подуровни.
Короче говоря, структура внешнего энергетического уровня щелочных металлов всегда одноэлектронная и обусловливает их способность образовывать ионы с положительным зарядом, а также легкость вступления в химические реакции и связывание с другими атомами и молекулами.
Внешний энергетический уровень
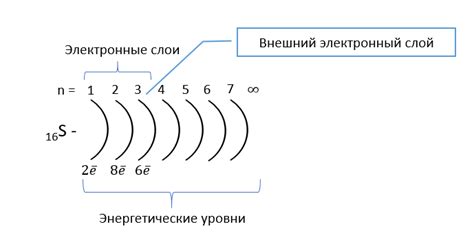
Внешний энергетический уровень в атоме щелочных металлов содержит всего 1 электрон. Он находится на самом высоком энергетическом уровне и является наиболее удаленным от ядра. Этот электрон, называемый валентным, обладает наибольшей энергией и определяет химические свойства и реактивность щелочных металлов.
Внешний энергетический уровень представляет собой область вокруг атомного ядра, в которой может находиться валентный электрон щелочных металлов. Так как этот энергетический уровень наиболее удален от ядра и содержит всего 1 электрон, он обладает достаточно низкой энергией, что делает это электронное облако несвязанным.
Валентный электрон щелочных металлов имеет сравнительно слабое притяжение к ядру, поэтому он может легко участвовать в химических реакциях и образовывать связи с другими атомами. Это объясняет активность щелочных металлов и их способность образовывать ионные соединения с другими элементами, а также реагировать с водой и кислородом.
Структура внешнего энергетического уровня

Структура внешнего энергетического уровня щелочных металлов характеризуется наличием только одного электрона на этом уровне. Щелочные металлы, такие как литий, натрий, калий и др., находятся в первой группе периодической таблицы элементов и имеют атомные номера от 3 до 11.
Внешний энергетический уровень, который содержит один электрон, называется валентным уровнем. Именно эти электроны на валентном уровне определяют химические и физические свойства щелочных металлов, так как они легко участвуют в химических реакциях и образуют ионы с положительным зарядом.
Валентный электрон в щелочных металлах обладает высокой энергией и легко удаляется из атома. Это делает эти металлы отличными веществами для использования в различных энергетических процессах. Например, калий и натрий используются в батареях и аккумуляторах, где происходит перемещение электронов между анодом и катодом.
Структура внешнего энергетического уровня щелочных металлов определяет их способность образовывать ионы с положительным зарядом и участвовать в реакциях с другими веществами. Это свойство делает их незаменимыми материалами в различных областях, таких как производство стекла, фармацевтическая промышленность и энергетика.
Щелочные металлы
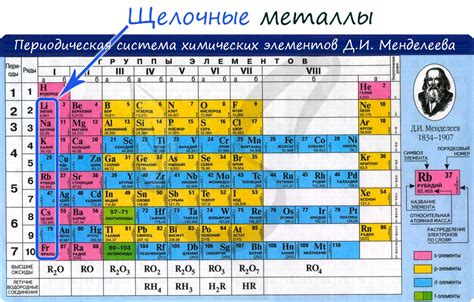
Щелочные металлы представляют собой группу элементов периодической системы, которые находятся в первой группе и обладают общей характеристикой - наличием всегда одного электрона во внешнем энергетическом уровне.
В данную группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они имеют металлическую структуру, химически активны и обладают низкой плотностью.
Внешний энергетический уровень этих элементов состоит только из одной s-орбитали, которая может находиться самой далеко от ядра по сравнению с другими энергетическими уровнями. Это делает эти металлы очень реактивными и способными образовывать ион положительного заряда.
В свободном состоянии щелочные металлы имеют серебристо-белый цвет, легко окисляются на воздухе и реагируют с водой, образуя щелочи. Они также обладают низкой температурой плавления и кипения, что делает их полезными в различных промышленных процессах.
Щелочные металлы широко используются в различных областях, включая производство щелочных батарей, литий-ионных аккумуляторов, стекла, лекарств и многого другого. Они также находят применение в научных исследованиях, особенно в области физики и химии.
Структура внешнего энергетического уровня щелочных металлов: всегда 1 электрон
Электрон – элементарная частица, обладающая отрицательным зарядом. Внешний энергетический уровень щелочных металлов всегда содержит только один электрон. Это делает их особенными и отличает от других элементов.
Электрон – основная единица структуры атома. Он располагается на энергетических уровнях вокруг ядра атома и определяет химические свойства элемента. В случае щелочных металлов, таких как литий, натрий, калий и др., внешний энергетический уровень заполнен одним электроном.
Один электрон на внешнем энергетическом уровне щелочных металлов обусловливает их химическую активность. Электрон может вступать в химические реакции с другими элементами, образуя ионы или соединения. Это объясняет высокую реакционность щелочных металлов и их способность образовывать соли и щелочи.
Структура внешнего энергетического уровня щелочных металлов также объясняет их химические свойства. Один электрон на этом уровне делает эти элементы легко возбудимыми и особенно податливыми к электромагнитным полям. Внешний электрон является ключевым фактором во многих свойствах щелочных металлов, таких как теплопроводность, электропроводность и способность к образованию сплавов.
Количество электронов во внешнем энергетическом уровне

Внешний энергетический уровень щелочных металлов всегда содержит один электрон. Это свойство обуславливает многие химические и физические свойства этих элементов.
Единственный электрон на внешнем уровне обладает высокой энергией и легко участвует в химических реакциях. Он может быть передан другим атомам, что способствует образованию ионов щелочных металлов с положительным зарядом.
Одиночный электрон во внешнем энергетическом уровне также обуславливает высокую реакционную способность щелочных металлов. Они с легкостью реагируют с водой, кислородом и другими веществами, образуя ионы и вещества с различными свойствами.
Также стоит отметить, что количество электронов на внешнем энергетическом уровне щелочных металлов меньше, чем у других элементов в периодической системе. Это делает их более склонными к образованию ионов и участию в химических реакциях.
Зависимость от вида щелочных металлов

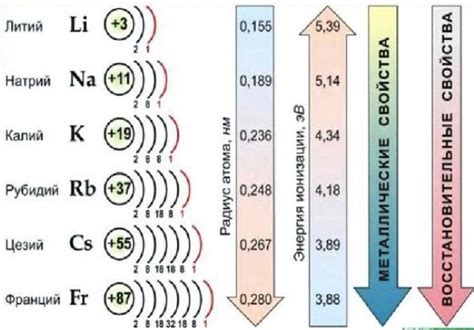
Щелочные металлы, такие как литий, натрий, калий и другие, имеют общую особенность - внешний энергетический уровень, содержащий всегда ровно один электрон. Однако, при более детальном рассмотрении можно заметить некоторые различия в структуре этого уровня в разных щелочных металлах.
Литий - самый легкий из щелочных металлов и имеет наибольшую электроотрицательность среди них. Это также отражается на его внешнем энергетическом уровне, который представлен одним электроном в s-орбитали с общим зарядом +1.
У натрия уже есть один набор s-орбиталей заполненных электронами, в то время как еще одна s-орбиталь будет содержать один электрон на внешнем энергетическом уровне. Это делает натрий более химически активным по сравнению с литием.
Калий, в свою очередь, имеет два набора s-орбиталей, заполненных электронами, а внешний энергетический уровень будет содержать одну электронную пару на s-орбитали. Поэтому, калий является еще более реактивным и химически активным металлом.
Итак, внешний энергетический уровень щелочных металлов всегда содержит один электрон, однако его структура может отличаться в зависимости от вида металла. Эти различия определяют химическую активность металлов и их способность образовывать химические связи с другими элементами.
Особенности структуры внешнего энергетического уровня

Внешний энергетический уровень щелочных металлов представляет собой последний энергетический уровень, на котором находится всего один электрон. Это делает этот уровень особенно важным и изучаемым в химии.
Один электрон на внешнем энергетическом уровне характеризует металлы данной группы как алкалии, так как они имеют склонность образовывать соединения с другими элементами. Они стремятся отдать этот свободный электрон и образовать положительный ион.
Структура внешнего энергетического уровня щелочных металлов обеспечивает им химическую активность и металлические свойства. Уровень представляет собой экранированный и отдаленный от ядра электрон. Это обеспечивает низкую энергию ионизации, что делает их металлические характеристики более заметными.
Внешний энергетический уровень щелочных металлов также определяет их способность образовывать ионы высокой зарядности. Наличие всего одного электрона делает их легкими катионами в реакциях с другими веществами. Это означает, что щелочные металлы обладают большим потенциалом для образования адсорбированных ионов на поверхности материала.
Вопрос-ответ

Почему энергетический уровень щелочных металлов всегда содержит 1 электрон?
Энергетический уровень щелочных металлов всегда содержит 1 электрон из-за своей электронной конфигурации. Щелочные металлы находятся в первой группе периодической системы и имеют одну валентную электронную оболочку. Следовательно, их внешний энергетический уровень может содержать только один электрон.
Что означает внешний энергетический уровень у щелочных металлов?
Внешний энергетический уровень у щелочных металлов - это энергетический уровень, на котором находятся валентные электроны. У этих металлов он всегда содержит один электрон.
Какая структура внешнего энергетического уровня у щелочных металлов?
Структура внешнего энергетического уровня щелочных металлов всегда одна и та же - он содержит один электрон. Этот электрон является валентным и находится на самом внешнем энергетическом уровне.
Есть ли исключения в структуре внешнего энергетического уровня щелочных металлов?
Нет, структура внешнего энергетического уровня щелочных металлов всегда одна и та же - он содержит один электрон. Валентный электрон находится на самом внешнем энергетическом уровне. Нет исключений для этой группы элементов.
Какая электронная конфигурация у щелочных металлов?
Электронная конфигурация щелочных металлов имеет общую формулу [ноблевый газ] ns1, где ns - энергетический уровень, на котором находится единственный валентный электрон. Ноблевый газ обозначает электронную конфигурацию предыдущего блока периодической системы, в которой не хватает одного электрона до заполнения последнего энергетического уровня.
