Щелочные металлы – это группа химических элементов, которые находятся в первой группе периодической таблицы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все эти элементы имеют общую характеристику – у них внешний электронный слой, состоящий из одного электрона.
Внешний электронный слой является самым дальним от ядра и играет важную роль в химических реакциях и свойствах элемента. В случае щелочных металлов, наличие только одного электрона во внешнем слое делает их очень реакционноспособными.
Этот электрон готов легко отдать свою энергию, чтобы образовать ионы положительного заряда. Именно поэтому щелочные металлы обладают сильными основными свойствами и способностью реагировать с кислородом, водой и другими реагентами.
Кроме того, наличие одного электрона во внешнем электронном слое делает щелочные металлы хорошими проводниками электричества и тепла. Их электроны могут легко передвигаться по металлической решетке, что делает их полезными во множестве технических и промышленных областей.
Все щелочные металлы, с их внешним электронным слоем, обладают уникальными свойствами, делающими их важными элементами для науки и нашей повседневной жизни. Изучение химического поведения и реакций этих элементов способствует разработке новых материалов и технологий.
Внешний электронный слой
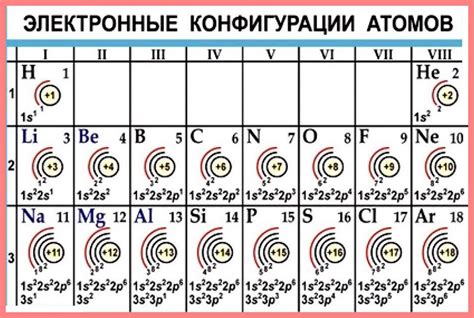
Внешний электронный слой – это наружный слой электронов, который находится на самом удаленном от ядра уровне энергии атома. Именно эти электроны влияют на химические свойства и реактивность атомов.
У щелочных металлов внешний электронный слой состоит из одного электрона. Именно поэтому они обладают высокой реактивностью и легко вступают в химические реакции. Этот электрон является свободным, то есть не укреплен ни к одному конкретному атому, и способен перемещаться между атомами.
Способность щелочных металлов отдавать этот внешний электрон делает их хорошими проводниками электричества. Они образуют ионные соединения с другими элементами, при этом отдают этот лишний электрон и становятся ионами с положительным зарядом.
Атомный радиус – это половина расстояния между центрами ядра двух соседних атомов в кристаллической решетке. У щелочных металлов атомный радиус увеличивается вниз по группе, так как увеличивается количество электронных уровней и уровень энергии внешних электронов.
Химические свойства щелочных металлов определяются их внешним электронным слоем. Именно наличие одного электрона во внешнем слое делает их наиболее реакционноспособными элементами, которые легко вступают в химические реакции. Это, в свою очередь, делает щелочные металлы важными и широко используемыми в различных областях науки и техники.
Особенности щелочных металлов

Щелочные металлы в химической периодической системе расположены в первой группе и включают элементы литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Главной особенностью этих металлов является наличие всего одного электрона в внешнем электронном слое. Это делает их очень реактивными и свободными в химических реакциях.
Щелочные металлы обладают высокой химической активностью, так как имеют тенденцию отдавать этот один электрон и образовывать положительные ионы, как Na+, K+ или Li+. Именно из-за этой особенности щелочных металлов их встречают в природе главным образом в виде ионов и соединений с другими элементами.
Реактивность щелочных металлов приводит к тому, что они легко растворяются в воде, образуя щелочные растворы. Натрий и калий, например, сильно реагируют с водой, при этом выделяется водород и образуется щелочное растворение. Литий и рубидий также растворяются в воде, но реакция протекает более медленно.
Еще одной особенностью щелочных металлов является их низкая плотность. На самом деле, они являются самыми легкими металлами в периодической системе элементов. Например, литий имеет плотность всего 0,53 г/см³, что делает его легче даже некоторых типичных неметаллических элементов. Такая низкая плотность очень важна для некоторых приложений, например, в производстве легких конструкций.
Электронная конфигурация атома
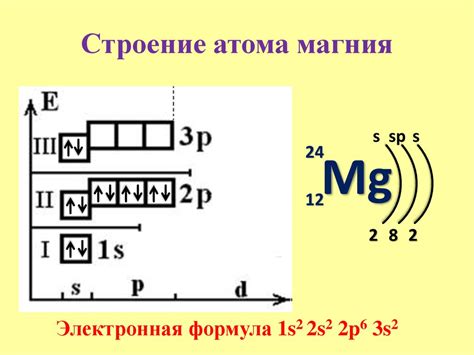
Электронная конфигурация атома - это упорядоченное распределение электронов атома по его энергетическим уровням и подуровням. Каждый атом имеет определенное количество электронов, расположенных на различных энергетических уровнях. Эти энергетические уровни разделены на подуровни, которые представляют собой суборбитальные области, внутри которых электроны находятся.
Atom's electrons occupy the lowest energy levels first before filling higher energy levels. The electron configuration is written using the number of electrons in each level and orbital. The electron configuration of an atom can be represented by using a series of numbers and letters such as 1s2 2s2 2p6. In this representation, each number represents a different energy level, the letter indicates the type of sublevel, and the superscript number indicates the number of electrons in that sublevel.
The outermost energy level of an atom is known as the valence shell. The valence shell determines the atom's reactivity and chemical properties. The alkali metals, which include elements such as lithium, sodium, and potassium, all have one electron in their outermost s orbital. This outer electron is easily lost, enabling alkali metals to readily form positive ions and exhibit high reactivity.
In conclusion, the electron configuration of an atom describes the arrangement of its electrons in energy levels and sublevels. The outermost energy level, known as the valence shell, plays a crucial role in determining an atom's reactivity. This understanding of electron configuration is essential in studying the chemical behavior and properties of different elements.
Реактивность щелочных металлов
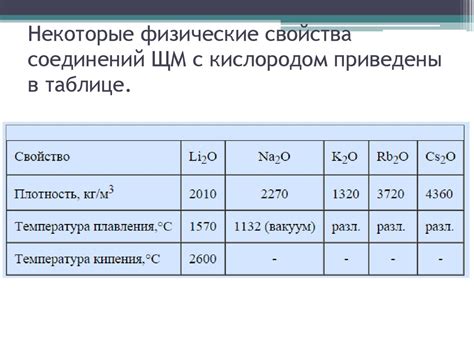
Щелочные металлы являются самыми реактивными элементами в периодической таблице. Они обладают малой энергией ионизации, что обуславливает их способность легко отдавать внешний электронный слой. Их внешний слой состоит из одного валентного электрона, и такая электронная конфигурация придает им высокую химическую активность.
Реактивность щелочных металлов проявляется в их способности активно взаимодействовать с другими веществами. Например, они легко реагируют с водой, образуя щелочные растворы и выделяя водород. Этот процесс происходит очень быстро и с выделением большого количества тепла. Реакция щелочных металлов с кислородом приводит к образованию оксидов, которые имеют щелочные свойства и легко растворяются в воде.
Щелочные металлы также реагируют с неметаллами, образуя соли. Например, их реакция с хлором приводит к образованию хлоридов, которые обладают высокой растворимостью в воде. Кроме того, щелочные металлы могут реагировать с кислотами, образуя соответствующие соли и выделяя водород.
Одной из наиболее известных реакций щелочных металлов является их горение в присутствии кислорода. При этом образуются оксиды, которые обладают ярким пламенем и сильно взрывоопасны. Горение щелочных металлов является одним из способов получения их оксидов для промышленных целей.
Вопрос-ответ

Что означает "внешний электронный слой"?
Внешний электронный слой - это электронный слой в атоме, расположенный на наибольшем радиусе от ядра и содержащий наименьшее количество электронов. Все атомы имеют несколько электронных слоев, и внешний слой играет важную роль в химических связях и реакциях.
Почему все щелочные металлы имеют внешний электронный слой?
Щелочные металлы расположены в первой группе периодической таблицы элементов, и у них в атоме всего один электрон во внешнем электронном слое. Это делает их химически активными, так как они стремятся отдать этот электрон и образовать ион положительного заряда. Именно такое поведение обуславливает их название "щелочные", так как они образуют щелочные оксиды и гидроксиды в растворах.
