Щелочные металлы - особая группа химических элементов, которые принадлежат к первой группе периодической системы. В их число входят литий, натрий, калий, рубидий, цезий и франций. Они являются самыми активными химическими элементами, способными к самым ярким химическим реакциям. Такая активность обусловлена особенностями их внешней электронной оболочки и стремлением к достижению наиболее стабильного состояния.
Щелочные металлы обладают высокой реакционной способностью, что позволяет им легко вступать в химические реакции с другими веществами. Они обладают способностью отдавать свой внешний электрон и образовывать положительно заряженные ионы. Благодаря этому свойству щелочные металлы применяются во многих областях науки и промышленности.
Щелочные металлы являются не только сильнейшими окислителями, но и самыми мощными восстановителями. Они способны эффективно передавать электроны другим веществам, переходя самостоятельно из одного восстановленного состояния в другое.
Применение щелочных металлов в настоящее время находит широкое применение в различных областях, включая энергетику, металлургию, химическую промышленность и медицину. Их способность быть самыми мощными восстановителями позволяет использовать их в процессе различных реакций и синтеза веществ. Благодаря высокой реакционной способности они участвуют в создании самых эффективных химических реакций и процессов, что делает их незаменимыми в разработке новых технологий.
Особенности щелочных металлов делают их уникальными в мире химии и открывают большие перспективы для исследований и применения в самых разных сферах деятельности человека. Их активность и способность к эффективному восстановлению делают щелочные металлы ценными элементами для современной науки и промышленности.
Щелочные металлы - сила восстановления

Щелочные металлы - это группа элементов периодической системы, включающая в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются самыми активными металлами и обладают высокой способностью восстанавливать вещества.
Восстановительные свойства щелочных металлов связаны с их высокой активностью, которая обусловлена малой энергией ионизации отдельных атомов. Благодаря этому, щелочные металлы легко отдают свой внешний электрон, образуя ионы положительного заряда.
Именно благодаря этой способности к восстановлению, щелочные металлы нашли широкое применение в различных областях. Например, литий используется в производстве аккумуляторов и лекарственных препаратов, натрий - в производстве химических реактивов и посудомоечных средств, калий - в производстве удобрений и стекла.
Щелочные металлы также играют важную роль в химической промышленности. Благодаря своей способности восстанавливать вещества, они используются в процессах экстракции, электролиза и многих других химических реакциях. Более того, щелочные металлы широко применяются в лаборатории для проведения химических экспериментов и исследований.
В заключение, следует отметить, что щелочные металлы являются мощными восстановителями и имеют множество полезных свойств. Их способность восстанавливать вещества находит применение в различных отраслях науки и промышленности, делая их незаменимыми и востребованными материалами.
Определение и свойства щелочных металлов

Щелочные металлы - это группа химических элементов из первой группы периодической таблицы, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой активностью и химической реактивностью.
Литий - самый легкий и наименее реактивный из щелочных металлов. Он имеет низкую плотность и низкую температуру плавления. Литий широко используется в производстве аккумуляторов и лекарств. Он проявляет высокую реакцию с водой.
Натрий - обычно присутствует в природе в виде солей. Этот металл имеет серебристый цвет и отличается высокой реактивностью. Натрий используется как пищевая добавка и в производстве стекла и мыла.
Калий - важный элемент для живых организмов, он присутствует во многих минералах и почвах. Калий используется в сельском хозяйстве для удобрений и регуляции водного баланса в организмах.
Рубидий - редкий щелочный металл, который имеет полезные свойства в электронике и оптике. Он используется в производстве лазеров, фоточувствительных элементов и специальных стекол.
Цезий - самый реактивный из щелочных металлов. Он подвержен ядерному распаду и используется в научных исследованиях и варисторах.
Франций - радиоактивный щелочный металл, который имеет крайне короткое время жизни. Он служит для научных исследований и не имеет практического применения.
Щелочные металлы отличаются высокой реакцией с водой и оксидами, а также хорошей проводимостью электричества. Они играют важную роль в различных областях, включая энергетику, медицину и промышленность.
Применение щелочных металлов в промышленности

Щелочные металлы, такие как литий, натрий и калий, являются неотъемлемой частью промышленных процессов и находят широкое применение в различных отраслях.
Одно из основных применений щелочных металлов – производство щелочи, основного компонента в процессе внутригородской очистки воды и производства стекла. Натрий и калий применяются в процессе электролиза, позволяющего получать щелочь высокой степени очистки. Щелочные металлы также используются в производстве мыла, моющих средств и моющих порошков.
Щелочные металлы находят применение в аккумуляторах, благодаря своей способности вступать в реакции восстановления и окисления. Литиевые ищелочь-металлические аккумуляторы широко применяются в современной электротехнике и автомобильной промышленности.
Кроме того, натрий и калий используются в процессе производства алюминия. Большое количество энергии требуется для производства алюминия, и щелочные металлы, такие как натрий и калий, играют важную роль в процессе электролиза алюминиевого оксида.
Щелочные металлы также применяются в химической промышленности, в процессе синтеза основных химических соединений. Натрий используется в производстве щелочи, нитратов, карбонатов и других веществ. Калий применяется в производстве удобрений, обладает уникальными свойствами, способствующими росту растений и повышению урожайности.
Таким образом, щелочные металлы играют важную роль в промышленности, находя применение в различных отраслях, от производства стекла и мыла до производства аккумуляторов и удобрений.
Важность щелочных металлов для человеческого организма

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, представляют огромную важность для правильного функционирования человеческого организма. Эти элементы играют роль в множестве физиологических процессов, контролируют уровень pH крови и поддерживают работу нервной системы.
Литий является одним из основных щелочных металлов, используемых в лекарственных препаратах для лечения психических расстройств, таких как биполярное расстройство и депрессия. Он помогает стабилизировать настроение и облегчает симптомы этих заболеваний.
Натрий является основным ионом внеклеточной жидкости организма. Он помогает поддерживать нормальный уровень жидкости, регулирует кровяное давление и участвует в передаче нервных импульсов. Натрий также играет важную роль в равновесии электролитов и поддержании общего здоровья.
Калий является необходимым элементом для правильной работы сердечно-сосудистой системы и нервной системы. Он участвует в передаче нервных импульсов, регулирует сократимость сердцевидных мышц и поддерживает нормальный уровень кровяного давления. Калий также способствует правильной функции мышц и поддерживает здоровье костей.
Рубидий и цезий имеют некоторые сходные свойства с калием и могут играть роль в регуляции кровяного давления. Однако, их влияние на организм все еще изучается.
В целом, щелочные металлы являются важными для поддержания здоровья организма. Они регулируют нервную систему, обеспечивают равновесие жидкостей и электролитов, контролируют давление и поддерживают нормальное функционирование сердца и других органов. Поэтому важно убедиться, что ваша диета содержит достаточное количество этих важных элементов или обсудить прием соответствующих препаратов с врачом.
Реакции и взаимодействие щелочных металлов
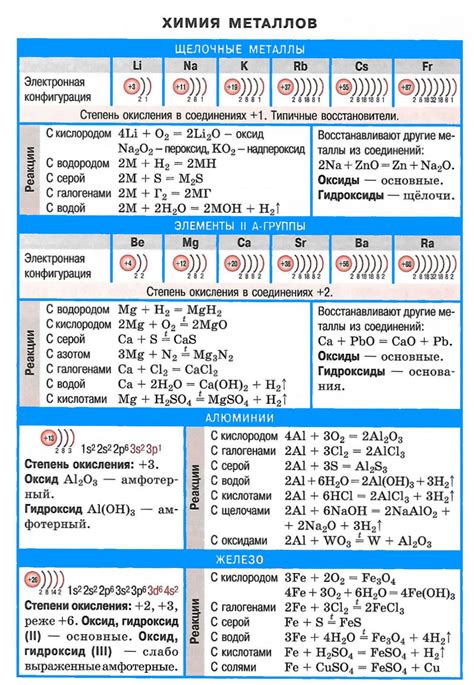
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, проявляют высокую реакционность в контакте с другими веществами. Это связано с их низкой ионизацией и электроотрицательностью, что делает их мощными восстановителями.
Одной из основных реакций щелочных металлов является реакция с водой. При контакте с водой металлы щелочной группы образуют щелочные гидроксиды и высвобождаются большие объемы водорода. Эта реакция является очень быстрой и сопровождается выделением большого количества тепла. Например, литий при контакте с водой реагирует с выделением пламени.
Другим важным взаимодействием щелочных металлов является реакция с кислородом. Щелочные металлы сильно реагируют с кислородом воздуха, образуя соответствующие оксиды. Например, натрий образует оксид натрия (Na2O), который проявляет щелочные свойства. Эта реакция обычно сопровождается выделением большого количества тепла и разрушением окружающего материала.
Кроме того, щелочные металлы проявляют реакцию с галогенами. При контакте с хлором, фтором, бромом или йодом образуются соответствующие галогениды щелочных металлов. Например, литий реагирует с хлором, образуя хлорид лития (LiCl). Эта реакция также сопровождается выделением тепла и является очень быстрой.
Кроме того, щелочные металлы могут проявлять активность в реакции с другими неорганическими и органическими соединениями. Например, натрий реагирует с углеродной кислотой, образуя соль и высвобождая водород. Это только некоторые примеры реакций и взаимодействий щелочных металлов, которые обусловлены их низкой электроотрицательностью и высокой реакционностью.
Риски и ограничения использования щелочных металлов

Щелочные металлы, такие как литий, натрий, калий и др., обладают множеством полезных свойств и нашли широкое применение в различных областях науки и техники. Однако их использование также сопряжено с определенными рисками и ограничениями.
Одним из основных рисков является их высокая реактивность. Щелочные металлы с легкостью реагируют с водой, влагой и воздухом, что может привести к возгоранию или даже взрыву. Поэтому при работе с ними необходимо соблюдать особые меры предосторожности и работать в специально оборудованных помещениях.
Другим значимым ограничением является их высокая стоимость и нестабильность цен. Щелочные металлы являются редкими и дорогостоящими элементами, что делает их использование не всегда экономически выгодным. Более того, спрос на них может сильно варьироваться, что влияет на их цену и доступность для потребителей.
Также следует отметить, что щелочные металлы обладают высокой реактивностью и могут вызывать серьезные проблемы с безопасностью. Неправильное хранение или использование может привести к авариям и нанести ущерб окружающей среде и здоровью людей. Поэтому необходимо соблюдать строгие правила и нормы безопасности при работе с ними.
В целом, использование щелочных металлов требует особого внимания к безопасности и соблюдения всех необходимых мер предосторожности. При правильном их использовании и хранении, можно получить значительные преимущества и достичь высокой эффективности в различных областях применения.
Вопрос-ответ

Какие металлы являются щелочными?
Щелочными металлами являются литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
В чем особенность щелочных металлов?
Одной из особенностей щелочных металлов является их реактивность. Они очень активно взаимодействуют с кислородом и водой, способны гореть на воздухе и имеют низкую температуру плавления. Кроме того, щелочные металлы являются отличными восстановителями, то есть способны передавать электроны другим веществам.
В чем применение щелочных металлов?
Щелочные металлы находят широкое применение в разных областях. Например, литий используется в производстве аккумуляторов и препаратах от психических расстройств, натрий используется в пищевой и химической промышленности, а калий применяется в удобрениях и производстве стекла.
Почему щелочные металлы считаются самыми мощными восстановителями?
Щелочные металлы считаются самыми мощными восстановителями из-за своей способности легко отдавать электроны другим веществам. Они имеют одно электрон во внешней оболочке, которое они готовы отдать, чтобы образовать стабильную конфигурацию. Благодаря этой способности, щелочные металлы могут вступать в реакции с различными веществами и проявлять высокую активность в химических процессах.
