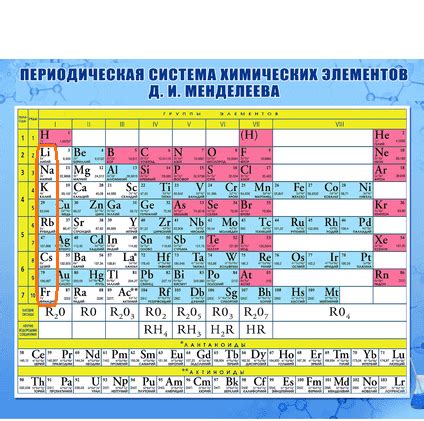
Щелочные металлы - это группа элементов, которые находятся на первой группе периодической системы. В эту группу входят такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Каждый из этих элементов характеризуется высокой активностью и реакционностью, а также обладает схожими химическими и физическими свойствами.
Несмотря на то, что все щелочные металлы находятся в одной группе периодической системы, они не относятся к одному периоду. На самом деле, щелочные металлы принадлежат к разным периодам в зависимости от своей атомной структуры.
Каждый период в периодической системе представляет собой горизонтальную строку элементов, в которой увеличивается количество энергетических уровней электронов. Щелочные металлы находятся в первом периоде, за исключением гидрогена (H), который также относится к этой группе, но находится в первом периоде.
Общая химическая и физическая активность щелочных металлов объясняется тем, что у них внешний s-электрон валентного уровня, что позволяет им легко переходить в октетное состояние путем потери этого электрона.
Таким образом, щелочные металлы могут иметь схожие свойства и совместное участие в химических реакциях, но они относятся к разным периодам периодической системы на основе своей атомной структуры и расположения в ней.
Определение щелочных металлов

Щелочные металлы - это группа элементов, которые относятся к первой группе периодической таблицы химических элементов. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы характеризуются высокой реактивностью и химической активностью.
Основным признаком щелочных металлов является наличие одной валентной электронной оболочки, что делает их очень реактивными. Они образуют ионы с положительным зарядом, легко взаимодействуют с другими элементами и образуют сольные соединения.
Щелочные металлы обладают характерными физическими и химическими свойствами, такими как низкая плотность, низкая температура плавления и кипения, мягкость и хорошая теплопроводность. Они также обладают высокой реакцией с водой, образуя щелочные растворы и выделяя газ водород.
Другой характерной особенностью щелочных металлов является их способность образовывать сплавы с другими металлами, что позволяет использовать их в различных областях промышленности, включая производство лития-ионных аккумуляторов, сплавов для аэрокосмической промышленности и производство стекла.
Периодическая таблица элементов
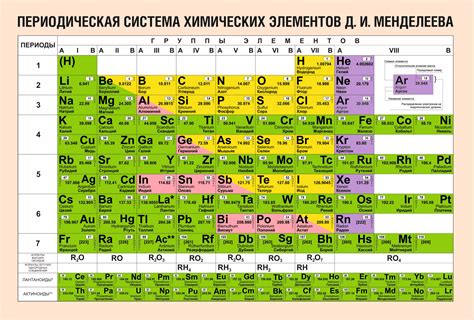
Периодическая таблица элементов - это систематическое представление химических элементов, составляющих все вещество на Земле, в виде таблицы. Она представляет собой удобную и компактную форму организации информации об элементах и их свойствах. Главными элементами данной таблицы являются горизонтали, называемые периодами, и вертикали, называемые группами.
В периодической таблице элементов каждому элементу присвоен уникальный номер - атомный номер, а также обозначение, состоящее из символа и одного или двух буквенных индексов. Также в таблице указывается относительная атомная масса, электронная конфигурация и химические свойства элементов.
Периодическая таблица элементов имеет особое значение в химии, поскольку она позволяет предсказывать и объяснять множество химических реакций и свойств элементов. Эта таблица позволяет установить закономерности в поведении элементов и их реакциях, что облегчает изучение и понимание химических процессов.
В таблице элементы расположены в порядке увеличения атомного номера. Каждый новый период начинается с ввода очередного электронного уровня. Группы элементов в таблице имеют сходные химические свойства и образуют колонки. Всего в таблице существует 18 групп.
Таким образом, периодическая таблица элементов является важным инструментом в химии и позволяет систематизировать и изучать свойства химических элементов.
Щелочные металлы в периодической таблице
Щелочные металлы являются одной из групп элементов в периодической таблице химических элементов. Все они относятся к одной группе – первой группе. Всего в группе щелочных металлов находятся шесть элементов: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Химические свойства щелочных металлов обусловлены их внешней электронной конфигурацией. Все щелочные металлы имеют одну валентную электронную оболочку с одним электроном, что делает их очень реактивными и химически активными. Щелочные металлы легко образуют ионы с положительным зарядом и образуют стабильные соединения с другими элементами.
Одной из особенностей щелочных металлов является их реакция с водой. При контакте с водой они образуют щелочные растворы и выделяются водород. Эта реакция является очень активной и может привести к возгоранию.
Щелочные металлы имеют низкую плотность и низкую точку плавления. Они хорошо проводят тепло и электричество, и часто используются в промышленности для изготовления сплавов и аккумуляторов. Будучи очень реактивными, они также имеют широкое применение в химической промышленности и лабораториях.
Щелочные металлы имеют важное значение в нашей жизни. Например, калий является важным элементом для растений и используется в удобрениях. Натрий и калий необходимы для нормального функционирования организма человека и содержатся в пищевых продуктах.
Физические свойства щелочных металлов

Щелочные металлы – это группа элементов, которые находятся в первой группе периодической системы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих металлов есть множество физических свойств, которые делают их уникальными и полезными в различных областях науки и техники.
Первое физическое свойство щелочных металлов – это их низкая плотность. Они отличаются от других металлов тем, что имеют меньшую массу при заданном объеме. Например, литий имеет плотность всего 0,53 г/см3, что делает его одним из самых легких металлов. Это свойство делает щелочные металлы удобными для использования в легких конструкциях и компонентах.
Второе физическое свойство – это их низкая температура плавления. Щелочные металлы обладают очень низкой температурой плавления по сравнению с другими металлами. Например, ртуть – это металл с низкой температурой плавления, но она все равно значительно выше, чем у щелочных металлов. Калий, например, плавится при температуре всего 63°C. Это свойство делает щелочные металлы удобными для использования в низкотемпературных приложениях и устройствах.
Третье физическое свойство щелочных металлов – это их высокая реактивность. Щелочные металлы являются очень реактивными и активно взаимодействуют с водой, воздухом и другими веществами. Они образуют щелочные растворы, реагируют с кислотами и образуют соли. Эта высокая реактивность делает их полезными для использования в химической промышленности, а также в процессах синтеза и анализа.
Металлический блеск и мягкость

Щелочные металлы - это группа химических элементов, которые обладают рядом общих свойств. Одним из таких свойств является металлический блеск. В связи с наличием свободных электронов, поверхность щелочных металлов рефлектирует свет и придает им блестящий внешний вид.
Еще одним характеристическим свойством щелочных металлов является их мягкость. Они являются самыми мягкими из всех известных металлов и могут быть легко разрезаны ножом или нажаты пальцем. Эта мягкость обусловлена их атомной структурой и слабыми связями между атомами металла, что делает их более податливыми.
Такая мягкость щелочных металлов также приводит к низким температурам плавления и кипения. Они имеют самые низкие точки плавления и кипения среди всех металлов, что делает их легко переходящими в жидкое состояние при небольших изменениях температуры.
Стоит отметить, что в ряду щелочных металлов существуют некоторые отличия. Калий и натрий, например, более мягкие и менее плотные, чем другие щелочные металлы. Литий же является самым легким из них и имеет наименьшую плотность. Такие различия в свойствах металлов важны для понимания их химических реакций и применения в различных сферах научных и технических исследований.
Низкая плотность и низкая температура плавления
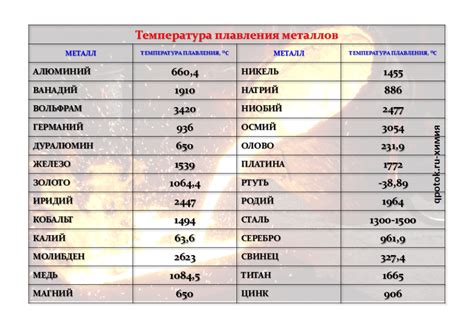
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., обладают низкой плотностью и низкой температурой плавления.
Низкая плотность щелочных металлов объясняется их атомной структурой. Атомы щелочных металлов имеют большой радиус и слабо связаны между собой. Большая межатомная дистанция приводит к низкой плотности материала. Например, литий является самым легким металлом и обладает наименьшей плотностью среди всех металлов.
Низкая температура плавления щелочных металлов также связана с их атомной структурой и слабыми взаимодействиями между атомами. Щелочные металлы имеют простую кубическую упаковку атомов, что снижает энергию сил притяжения между атомами. В результате, уже при низких температурах атомы щелочных металлов начинают подвергаться тепловому движению и разделяться друг от друга. К примеру, калий имеет низкую температуру плавления всего около 63 градусов Цельсия.
Высокая активность щелочных металлов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, отличаются своей высокой активностью. Они проявляют сильное взаимодействие с водой и многими другими веществами.
Активность щелочных металлов обусловлена их низкой ионизационной энергией, которая позволяет им легко отдавать свой внешний электрон и образовывать положительно заряженный ион. Это явление делает их химически активными и реактивными элементами.
Например, когда щелочные металлы попадают в контакт с водой, они реагируют с ней с превращением в щелочные гидроксиды. Особенно яркое проявление этого взаимодействия наблюдается с литием и натрием.
Также щелочные металлы активно реагируют с кислородом, азотом и многими неорганическими и органическими соединениями. Они применяются в различных сферах, таких как производство легких металлов, батарей и фармацевтических препаратов.
Вообще, щелочные металлы характеризуются высокой химической активностью, что делает их важными исследовательскими объектами и применяемыми в различных индустриях. Их активность позволяет им образовывать многочисленные соединения и восстанавливать ряд металлов.
Химические свойства щелочных металлов

Щелочные металлы – это элементы первой группы периодической системы, включающие литий, натрий, калий, рубидий, цезий и франций. Они обладают рядом химических свойств, которые делают их уникальными и важными для различных отраслей науки и промышленности.
1. Высокая реакционная способность: Щелочные металлы являются самыми реакционноспособными элементами. Они активно взаимодействуют с воздухом, водой и другими веществами, образуя соли и газы. Эта способность делает их незаменимыми материалами для производства различных химических соединений.
2. Образование щелочных растворов: Щелочные металлы образуют щелочные растворы при взаимодействии с водой. Щелочные растворы обладают щелочными свойствами, то есть они оказывают щелочное действие на другие вещества. Это свойство используется в процессе нейтрализации кислот, в медицине и в бытовых целях.
3. Высокая электроотрицательность: Щелочные металлы отличаются высокой электроотрицательностью, что делает их хорошими металлами-проводниками электричества. Они используются в производстве батарей, электродов и других электронных устройств.
4. Образование сплавов: Щелочные металлы способны образовывать сплавы с другими металлами. Это позволяет им стать основой для создания различных металлических материалов, таких как алюминий, магний и многие другие сплавы.
5. Большая реакционная способность со средними и тяжелыми элементами: Щелочные металлы могут вступать в реакции с другими элементами, в том числе с средними и тяжелыми, что делает их ценными в процессе получения различных соединений и материалов.
- Щелочные металлы обладают высокой термостойкостью, что позволяет их использовать в процессе нагрева и переработки различных материалов и соединений.
- Они имеют низкую плотность, что делает их легкими и удобными для транспортировки и использования в различных инженерных и технических приложениях.
Таким образом, химические свойства щелочных металлов делают их важными и необходимыми в различных областях науки, промышленности и повседневной жизни. Их способность к реакциям и образованию соединений позволяет использовать их в процессах производства, научных исследований и медицине.
Электроотрицательность и реактивность

Электроотрицательность является одним из основных показателей химической активности элементов. В контексте щелочных металлов, она определяет их способность принимать или отдавать электроны, что влияет на их реактивность.
Щелочные металлы, такие как литий, натрий, калий и др., обладают низкой электроотрицательностью. Это означает, что они имеют склонность отдавать электроны и образовывать положительные ионы. В результате, они легко реагируют с другими веществами, особенно с кислородом и водой.
Реактивность щелочных металлов проявляется в их способности образовывать сильно щелочные растворы, обеспечивая вещества с высоким pH значением. Они также могут реагировать с кислотами, образуя соли. Это явление часто наблюдается в реакциях щелочных металлов с водой, когда образуются гидроксиды щелочных металлов и выделяется водород.
Общая химическая активность щелочных металлов, связанная с их электроотрицательностью и реактивностью, делает их важными элементами в различных областях, включая производство промышленных химических веществ, батареек и других электронных устройств.
Вопрос-ответ

Какие элементы относятся к щелочным металлам?
К щелочным металлам относятся элементы первой группы периодической системы, а именно литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Что такое периодическая система элементов?
Периодическая система элементов - это классификация химических элементов, в которой элементы располагаются в порядке возрастания атомного номера. Она упорядочена по группам и периодам, отражая свойства элементов и их электронную структуру.
Все ли щелочные металлы относятся к одному периоду?
Нет, не все. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, относятся ко второму периоду, а франций относится к седьмому периоду периодической системы элементов.
Какова общая химическая характеристика щелочных металлов?
Щелочные металлы обладают высокой реактивностью и легко реагируют с водой, кислородом и другими веществами. Они образуют ионы с положительным зарядом, легко отдают один электрон и образуют сильные щелочные растворы.