Оксиды металлов - это химические соединения, состоящие из кислорода и металла. В отличие от оксидов неметаллов, которые могут быть как твердыми, так и газообразными или жидкими, все оксиды металлов являются твердыми веществами.
Твердость оксидов металлов обусловлена их кристаллической структурой. В кристаллической решетке атомы металла и атомы кислорода связаны тесно друг с другом, образуя прочную структуру. Это позволяет оксидам металлов иметь высокую температуру плавления и быть твердыми при обычных условиях.
Твердые оксиды металлов широко используются в различных отраслях промышленности. Они используются в производстве керамики и стекла, при производстве электроники и полупроводников, в каталитических реакциях и многих других процессах. Благодаря своей твердости, оксиды металлов обладают высокими механическими свойствами, что делает их востребованными материалами для создания прочных и долговечных изделий.
Все металлические оксиды твердые
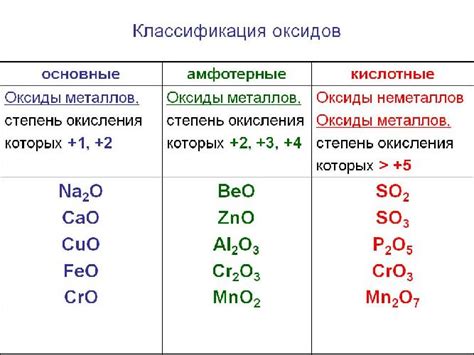
Все оксиды металлов являются твердыми соединениями, образующимися в результате соединения кислорода с металлами. Оксиды представляют собой соли, состоящие из металлического катиона и кислородного аниона. Такая структура обуславливает их твердость.
Металлические оксиды отличаются своими физическими и химическими свойствами. Они обладают высокой плотностью, тугоплавкостью и жесткостью. Кристаллическая структура оксидов может быть разнообразной, например, оксид алюминия образует корундовую структуру, а оксид железа может образовывать магнетит или гематит.
Все металлические оксиды обладают кислотными свойствами и образуют щелочные растворы при взаимодействии с водой. Однако, не все оксиды растворимы, некоторые из них образуют нерастворимые основания, например, оксид кальция образует нерастворимый гидроксид кальция (известь).
Металлические оксиды широко применяются в различных отраслях промышленности. Например, оксид железа используется в производстве стали, оксид кремния применяется для получения кремниевых материалов, а оксид алюминия используется в производстве керамики и электролитического алюминия.
Оксид железа

Оксид железа – это химическое соединение железа с кислородом. Существует несколько основных форм оксида железа, включая двухвалентный оксид железа (FeO), трехвалентный оксид железа (Fe2O3) и четырехвалентный оксид железа (Fe3O4).
Двухвалентный оксид железа, известный также как железная окись (II), является черным кристаллическим веществом. Он используется как катализатор для некоторых химических реакций и в процессе производства стекла.
Трехвалентный оксид железа, известный как гематит, находит широкое применение в производстве стали, керамики и красителей.
Четырехвалентный оксид железа, известный как магнетит, обладает магнитными свойствами и используется в производстве магнитов.
Оксид железа широко распространен в природе, он является составной частью многих минералов и почв. Он также может быть получен искусственным путем при нагревании железа в присутствии кислорода.
Оксид алюминия

Оксид алюминия (Al2O3) - это химическое соединение, состоящее из атомов алюминия и кислорода. Он является одним из наиболее распространенных оксидов металлов и широко используется в различных отраслях промышленности.
Оксид алюминия обладает высокой температурной стабильностью, хорошей термической и электрической изоляцией. Это делает его незаменимым материалом в производстве керамики, стекла, электроизоляционных изделий и огнеупорных материалов.
Оксид алюминия обладает также высокими механическими свойствами, такими как прочность и твердость. Поэтому он используется в производстве шлифовальных материалов, абразивных колес и отполированных поверхностей.
Оксид алюминия также широко применяется в качестве катализатора в различных химических процессах. Он обладает свойствами, позволяющими активировать реакции окисления, гидрообразования, гидрирования и дегидрирования, что делает его неотъемлемым элементом многих промышленных процессов.
В заключение, оксид алюминия представляет собой важное химическое соединение, имеющее широкий спектр применений в различных сферах промышленности и науки. Его уникальные свойства делают его ценным материалом, способствующим развитию технологий и научному прогрессу.
Оксид кальция

Оксид кальция, также известный как известь или гипс, является твердым веществом, содержащимся в природе в виде минерала известковца. Он широко используется в различных отраслях, включая строительство, стекольную промышленность и медицину.
Известность оксида кальция объясняется его свойствами. Во-первых, он обладает высокой термической стабильностью, что делает его идеальным для применения в огнеупорных материалах. Во-вторых, оксид кальция имеет щелочные свойства, что позволяет его использовать в процессе нейтрализации кислот. Кроме того, этот оксид является хорошим проводником электричества и широко применяется в электротехнике.
Одним из основных применений оксида кальция является его использование в строительстве. Он используется как один из компонентов цемента, который в свою очередь используется для создания бетона и строительных материалов. Оксид кальция также широко применяется в стекольной промышленности для производства стекла и керамики.
Медицинская промышленность также активно использует оксид кальция. Он применяется в виде гипсового повязочного материала для фиксации поврежденных костей или суставов. Также оксид кальция используется в зубных пастах и антацидах для нейтрализации кислоты в желудке.
Оксид магния

Оксид магния является химическим соединением, состоящим из атомов магния и кислорода. Его формула представлена как MgO. Это кристаллическое вещество, которое обладает высокой теплостойкостью и устойчивостью к большинству химических веществ.
Оксид магния широко применяется в различных отраслях промышленности и научных исследованиях. Он является основным компонентом в производстве огнеупорных материалов, таких как огнеупорные кирпичи и тигли. Благодаря своим свойствам, оксид магния является эффективным защитным покрытием для поверхностей, подверженных высокой температуре.
Оксид магния также используется в производстве щелочного аккумулятора, который является одним из наиболее распространенных типов аккумуляторов. Он также широко используется в производстве керамики, стекла и различных электронных компонентов.
С точки зрения медицины, оксид магния играет важную роль в фармацевтической и медицинской промышленности. Он используется в качестве средства от запоров и как антацид для облегчения изжоги и различных желудочных проблем.
В целом, оксид магния является важным химическим соединением, которое широко используется в различных отраслях промышленности и имеет важные приложения в медицине. Его уникальные свойства делают его незаменимым материалом для многих процессов и продуктов.
Оксид цинка

Оксид цинка (ZnO) - это белый, твердый неорганический соединение цинка и кислорода. Этот оксид обладает множеством уникальных свойств и находит широкое применение в различных областях науки и техники.
Оксид цинка является полупроводниковым материалом, который обладает широкой запрещенной зоной по сравнению с другими оксидами металлов. Это делает его незаменимым в электронике и солнечных батареях.
Благодаря своим фотокаталитическим свойствам, оксид цинка используется в производстве солнцезащитных кремов и лосьонов. Он обладает способностью поглощать ультрафиолетовые лучи и предотвращать повреждение кожи от солнечного излучения.
Оксид цинка также используется в керамике и стекле для придания им определенных свойств. Он обладает высокой прочностью и устойчивостью к теплу, что позволяет использовать его в производстве огнеупорных материалов.
Кроме того, оксид цинка находит применение в медицине, где используется в качестве антисептика и противозачаточного средства. Он эффективен против бактерий, грибков и вирусов, и поэтому часто используется для лечения различных инфекционных заболеваний.
Оксид свинца

Оксид свинца (PbO), также известный как оксид свинца (II), является соединением химического элемента свинца с кислородом. Этот твердый кристаллический вещество имеет белый или желтый цвет, в зависимости от его формы и чистоты.
Оксид свинца имеет несколько различных аллотропных форм, включая кромкулит, сенармонтит и литаргирит. Он обладает хорошей термической и электрической проводимостью и смешивается со многими другими соединениями, такими как кислоты и основания.
Используется оксид свинца в различных областях промышленности. Например, его можно найти в производстве стекла, аккумуляторов, керамики, пигментов и пломбировочных материалов. Он также применяется в электронике для создания полупроводниковых материалов и терморезисторов.
Кроме промышленных применений, оксид свинца был использован в медицине для лечения определенных заболеваний. Несмотря на это, он имеет высокую токсичность и может накапливаться в организме, что может привести к серьезным последствиям для здоровья.
В заключение, оксид свинца является важным соединением металла свинца с кислородом. Он обладает различными химическими и физическими свойствами, а также находит широкое применение в различных отраслях промышленности.
Вопрос-ответ

Почему все оксиды металлов твердые?
Все оксиды металлов твердые, потому что они имеют кристаллическую структуру. В кристаллической структуре оксида металла атомы связаны между собой через ионы кислорода. Эта структура обладает высокой устойчивостью и прочностью, что делает оксиды металлов твердыми в обычных условиях.
Может ли быть исключение и существовать газообразные оксиды металлов?
В обычных условиях газообразные оксиды металлов не существуют. Однако при повышенных температурах и давлениях некоторые оксиды металлов могут переходить в газообразное состояние. Например, оксид азота (NO) является газообразным оксидом, но он образуется из неметалла азота, а не металла.
Какие факторы влияют на температуру плавления оксидов металлов?
Температура плавления оксидов металлов зависит от их химического состава и структуры. Некоторые оксиды металлов, например, оксиды щелочных металлов (натрия, калия и т.д.), имеют низкую температуру плавления и являются жидкими при комнатной температуре. В то же время, оксиды переходных металлов имеют более высокую температуру плавления и являются твердыми в обычных условиях.
