Амфотерность - это способность вещества проявлять кислотные и основные свойства в зависимости от условий. Несмотря на то, что амфотерные соединения наиболее часто связывают с неметаллами, многие металлы также обладают амфотерными свойствами. Амфотерные металлы способны реагировать как с кислотами, так и с основаниями, проявляя тем самым уникальные химические свойства.
Единственным известным элементом, обладающим исключительно амфотерными свойствами, является алюминий. В органической химии алюминий используется для получения солей и альбуминатов, которые применяются в текстильной и пищевой промышленности. Кроме того, алюминья является важным компонентом в производстве многочисленных металлов и сплавов.
Другим металлом с амфотерными свойствами является цинк. Цинк, реагируя с кислотами, образует соли, а с основаниями - гидроксид цинка. Присутствие цинка в органическом веществе способствует его защите от коррозии, а применение цинка в промышленности обеспечивает производство сплавов и аккумуляторов.
Амфотерные свойства металлов обусловлены их электронной структурой и способностью образовывать стабильные соединения с различными элементами. Эти свойства могут быть использованы для создания новых материалов и применены в широком спектре индустриальных процессов.
Амфотерные свойства металлов
Амфотерными называются вещества, которые могут реагировать как с кислотами, так и с щелочами. В случае металлов, амфотерность означает их способность образовывать ионы исключительно катионные типа Мn+ в кислотных растворах и анионные типа M(OH)nm- в щелочных растворах.
Особенность амфотерных свойств металлов проявляется в их способности образовывать соли как с кислотами, так и с основаниями. В кислых средах металлы взаимодействуют с ионами водорода, образуя ионы в меньшей степени окисления. В щелочных средах металлы взаимодействуют с ионами гидроксида, образуя гидроксиды.
Среди амфотерных металлов особенно выделяются алюминий и цинк. Алюминий, например, может образовывать ионы Al3+ в кислотных растворах и ионы Al(OH)4- в щелочных растворах. Цинк может образовывать ионы Zn2+ в кислотных растворах и ионы Zn(OH)42- в щелочных растворах.
Амфотерные свойства металлов являются важными для понимания их реакционной способности в различных средах. Это позволяет применять металлы в разных целях, начиная от катализа реакций и заканчивая производством электрохимических систем. Амфотерные свойства металлов также имеют значение при изучении химических процессов в природных системах, включая гидросферу и биосферу.
Металлы с амфотерными свойствами

Амфотерные свойства металлов характеризуются их способностью реагировать как с кислотами, так и с щелочами. Такие металлы показывают различное поведение в зависимости от условий окружающей среды.
Одним из основных примеров металлов с амфотерными свойствами является алюминий. В контакте с кислотами, алюминий реагирует, и образуется соль и освобождается водород. Однако в щелочной среде алюминий ведет себя иначе - он образует гидроксид алюминия, который обладает щелочными свойствами.
Другим примером металла, обладающего амфотерными свойствами, является цинк. В контакте с кислотами цинк также образует соль и освобождает водород. В щелочной же среде цинк образует гидроксид цинка, который является основанием.
Одной из особенностей металлов с амфотерными свойствами является их реакция с водой. Например, алюминий взаимодействует с водой при нагревании и образует оксид алюминия и водород. А цинк при нагревании с водой образует оксид цинка и водород. Таким образом, эти металлы демонстрируют как амфотерные, так и редокс-свойства.
Изучение амфотерных свойств металлов имеет важное значение для практического применения. К примеру, такие металлы могут использоваться в процессе обезжиривания и очистки поверхностей от загрязнений, а также в производстве различных химических веществ, обладающих как кислотными, так и щелочными свойствами.
Химические реакции металлов
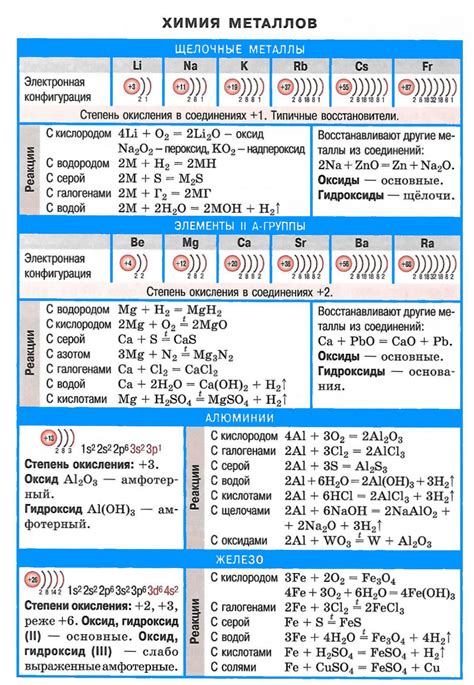
Металлы обладают способностью активно вступать в химические реакции, благодаря своей электроотрицательности и ионизационному потенциалу. Основные типы реакций, которые могут протекать с участием металлов, включают окислительно-восстановительные и реакции образования новых соединений.
В окислительно-восстановительных реакциях металлы вступают во взаимодействие с другими веществами, переходя из одной степени окисления в другую. Например, железо может вступать в реакцию с кислородом из воздуха, окисляясь и образуя ржавчину. Также металлы могут осуществлять восстановление веществ, например, некоторые металлы используются в процессе катализа, при котором они способны ускорять химическую реакцию.
Реакции образования новых соединений происходят, когда металл вступает во взаимодействие с кислотами, основаниями или другими веществами. Например, если алюминий поместить в соляную кислоту, произойдет образование соли алюминия и выделение водорода. При этом алюминий проявляет свои амфотерные свойства, то есть способность выступать как в качестве кислоты, так и в качестве основания.
Важно отметить, что химические реакции металлов могут быть спонтанными и высокоэнергетическими. Имеется большое множество промышленных процессов, которые используют реакцию металлов для получения нужных продуктов. Например, процесс получения алюминия из его руды основан на окислительно-восстановительной реакции соединения алюминия с кислородом при высоких температурах.
В заключение, химические реакции металлов являются основой для множества процессов в нашей жизни. Изучение и понимание данных реакций позволяет нам использовать металлы с максимальной эффективностью и создавать новые материалы и соединения для различных областей промышленности и технологии.
Примеры реакций

1. Реакция амфотерных оксидов с кислотами:
Амфотерные оксиды металлов, как, например, оксид алюминия (Al2O3), обладают способностью реагировать и с кислотами и с щелочами. При взаимодействии с кислотами образуется соль и вода. Например, оксид алюминия с раствором соляной кислоты дает соль – алюминий хлорид (AlCl3) и воду. Эта реакция происходит по следующему уравнению:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
2. Реакция амфотерных оксидов с щелочами:
Амфотерные оксиды также обладают способностью реагировать с щелочами. При этом образуются соли гидроксидов. Например, оксид алюминия с раствором натрия дает алюминий гидроксид (Al(OH)3) и натриев эзехлор — соль. Эта реакция происходит по следующему уравнению:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
3. Реакция с кислотными оксидами:
Амфотерные оксиды металлов также могут взаимодействовать с кислотными оксидами. Например, оксид меди (II) (CuO) реагирует с оксидом серы (IV) (SO2) и образует соль — сульфат меди (II) (CuSO4).
2CuO + SO2 → 2CuSO4
4. Образование амфотерных гидроксидов:
Некоторые металлы способны формировать амфотерные гидроксиды. Например, гидроксид алюминия (Al(OH)3) может реагировать как с щелочами, образуя алюминий гидроксидат, так и с кислотами, образуя алюминий оксохлорид и воду.
2Al(OH)3 + 6HCl → Al2OCl6 + 6H2O
Al(OH)3 + NaOH + H2O → Na[Al(OH)4]
Физические свойства амфотерных металлов

Амфотерные металлы – это класс веществ, обладающих способностью проявлять как кислотные, так и щелочные свойства в химических реакциях. Эти металлы представлены в периодической таблице и включают такие элементы, как алюминий, цинк, свинец, железо, медь и другие.
Физические свойства амфотерных металлов оказывают важное влияние на их поведение в различных условиях. Одним из основных физических свойств амфотерных металлов является их металлическая структура. Они обладают высокой теплопроводностью и электропроводностью, что делает их ценными материалами в различных областях, таких как электроника, металлургия и строительство.
Еще одним важным физическим свойством амфотерных металлов является их плотность. Амфотерные металлы, как правило, обладают высокой плотностью, что обусловлено тяжелыми атомами, составляющими их структуру. Это позволяет им быть прочными и устойчивыми к механическим воздействиям.
Другим физическим свойством амфотерных металлов является их возможность формирования различных модификаций и фаз. В зависимости от условий окружающей среды и температуры, амфотерные металлы могут образовывать разные структуры и химические соединения, что делает их универсальными материалами для различных приложений.
Все эти физические свойства амфотерных металлов определяют их поведение и взаимодействия с другими веществами. Благодаря своим уникальным свойствам, амфотерные металлы широко используются в различных производственных отраслях и находят применение в различных технологических процессах.
Применение амфотерных металлов

Амфотерные металлы – это металлы, которые обладают способностью взаимодействовать как с кислотами, так и с щелочами. Их амфотерность делает их незаменимыми во многих отраслях промышленности и науке.
Прежде всего, амфотерные металлы широко используются в производстве катализаторов. Металлы, такие как алюминий, кобальт, никель, железо, обладают способностью активировать химические реакции и ускорять их протекание. Благодаря этому, они находят применение в производстве пластмасс, фармацевтике, нефтехимической промышленности и других отраслях, где требуется контроль процесса.
Кроме того, амфотерные металлы активно применяются в производстве электроники и солнечных батарей. Алюминий, например, является одним из основных материалов для производства принтеров, мобильных телефонов и ноутбуков. Амфотерные металлы также используются в процессе создания полупроводников, одного из основных материалов для электронных устройств.
Также, благодаря своей устойчивости к коррозии, амфотерные металлы применяются в металлообработке и производстве авиационной и космической техники. Алюминий и его сплавы широко используются для создания самолетов, спутников, телескопов и других сложных технических устройств.
Наконец, амфотерные металлы активно применяются в производстве косметических средств и лекарств. Никель и цинк, например, используются в косметике для производства устойчивых пигментов и добавок к кремам и лосьонам. Амфотерные металлы также играют важную роль в фармакологии, где они используются для создания лекарственных соединений с целью борьбы с инфекционными заболеваниями и лечения различных патологий.
Вопрос-ответ

Какие металлы обладают амфотерными свойствами?
Амфотерными свойствами обладают большинство металлов, включая алюминий, свинец, цинк, железо, медь и т.д.
Что такое амфотерные свойства металлов?
Амфотерными свойствами металлов называется их способность проявлять как кислотные, так и основные характеристики в химических реакциях.
Как проявляются амфотерные свойства металлов?
Амфотерные свойства металлов проявляются в том, что они реагируют с кислотами, образуя соли, а также реагируют с основаниями, образуя гидроксиды или оксиды.
