Металлы, являющиеся активными элементами химической системы, проявляют свою активность при взаимодействии с кислотами. В результате такого взаимодействия происходит образование солей, являющихся основными компонентами многих химических реакций и процессов.
Образование солей при взаимодействии металлов с кислотами происходит в результате процесса диссоциации, когда ион металла образует связь с ионами кислоты, в результате чего образуется неорганическое соединение - соль. Происходящая первоначально реакция между кислотой и металлом носит необратимый характер.
Образование солей при взаимодействии металлов с кислотами зависит от ряда факторов, таких как реакционная способность металла и кислоты, концентрация реагентов, температура и условия проведения реакции. Кроме того, взаимодействие металлов с кислотами может проходить по разным механизмам: окислительно-восстановительной, кислотометрической или комплексообразующей реакциями.
Взаимодействие металлов с кислотами: общая информация

Взаимодействие металлов с кислотами представляет собой реакцию, в результате которой происходит образование солей. Этот процесс обусловлен химической активностью металлов и их способностью образовывать ионы положительного заряда.
В ходе взаимодействия кислоты и металла, металлический элемент вытесняет водород из кислоты, образуя при этом соль и выделяя газ. Например, взаимодействие магния и соляной кислоты приводит к образованию хлорида магния и выделению водорода.
Реактивность металлов определяется их положением в ряду активности. Как правило, наиболее активные металлы образуют соли более легко и глубоко взаимодействуют с кислотами, чем металлы менее активные. Например, натрий и калий вступают в реакцию с кислотами гораздо более интенсивно, чем железо или свинец.
Однако существуют и металлы, которые не реагируют с кислотами вообще. К таким металлам относятся благородные металлы, такие как золото и платина. Их малая химическая активность и стабильность делает их нереактивными с кислотами.
Химические реакции между металлами и кислотами

Химические реакции между металлами и кислотами являются важным объектом изучения в химии. При взаимодействии металлов с кислотами происходит образование солей и выделение водорода.
Взаимодействия металлов с кислотами основаны на разности активностей металлов и на возможности кислоты отдавать протоны. В химических реакциях участвуют ионы металлов и ионы водорода, которые образуют водородные ионы.
Самый распространённый пример реакции между металлом и кислотой – реакция железа (Fe) с соляной кислотой (HCl). При этом реагенты превращаются в хлорид железа (FeCl2 или FeCl3) и выделяется водород (H2). Эта реакция происходит по следующему уравнению:
2Fe + 6HCl → 2FeCl3 + 3H2
Другим примером реакции является взаимодействие цинка (Zn) с серной кислотой (H2SO4). В результате образуется сульфат цинка (ZnSO4) и выделяется водород. Уравнение реакции выглядит следующим образом:
Zn + H2SO4 → ZnSO4 + H2
Химические реакции между металлами и кислотами широко используются в промышленности и в повседневной жизни. Например, соляная кислота используется в процессе очистки металлических поверхностей от окислов и загрязнений, а серная кислота применяется при производстве батарей и удобрений.
Роль органических и неорганических кислот в образовании солей с металлами
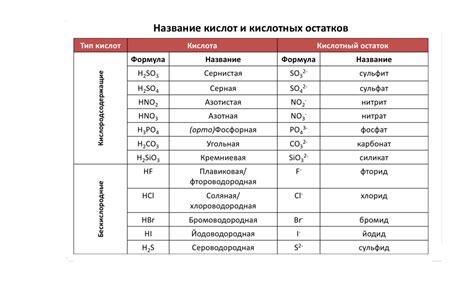
Органические и неорганические кислоты играют важную роль в образовании солей с металлами. Образование солей происходит при взаимодействии кислот с соответствующими металлами.
Органические кислоты образуют соли, которые широко используются в жизнедеятельности организмов. Например, аминокислоты являются основными строительными блоками белков, а нуклеиновые кислоты необходимы для передачи наследственной информации. Органические кислоты также используются в промышленности, лекарственной и пищевой промышленности.
Неорганические кислоты взаимодействуют с металлами и образуют неорганические соли. Эти соли широко применяются в различных отраслях промышленности и техники, например, для производства удобрений, стекла, керамики и металлургической продукции.
Для образования солей с металлами необходимо, чтобы кислота обладала определенными свойствами. В частности, должна быть насыщенная кислотная группа, которая может реагировать с металлом. Также важен pH среды, в которой происходит реакция образования соли.
Образование солей с металлами является важным процессом, который имеет многочисленные применения в науке, промышленности и медицине. Понимание роли органических и неорганических кислот в этом процессе позволяет развивать новые методы синтеза солей и создавать новые материалы с улучшенными свойствами.
Анализ особенностей образования солей в зависимости от типа металла и кислоты

Особенности образования солей:
1. Взаимодействие металлов с кислотами приводит к образованию солей - химических соединений, состоящих из положительно заряженного металлического ион и отрицательно заряженного иона кислоты.
2. Образование солей в значительной мере зависит от типа металла и кислоты, которые взаимодействуют.
3. Соли, образующиеся при взаимодействии кислот с щелочными металлами (например, натрием, калием), обладают высокой растворимостью в воде. Они образуют прозрачные растворы, легко растворяющиеся в воде. Примером таких солей является хлорид натрия - NaCl.
4. Взаимодействие кислот с некоторыми металлами, такими как железо, алюминий или цинк, может привести к образованию малорастворимых солей, таких как сульфат железа (FeSO4) или гидроксид алюминия (Al(OH)3). При образовании таких солей обычно наблюдается выпадение осадка.
5. Кроме того, соли могут образовываться при взаимодействии кислот с основными оксидами металлов. Например, образование активной реакции между серной кислотой (H2SO4) и оксидом меди (CuO) приводит к образованию сульфата меди (CuSO4).
6. Образование солей также может зависеть от степени окисления металла в исходном веществе и кислотности среды.
Таким образом, образование солей при взаимодействии металлов с кислотами может быть определено типом металла и кислоты, а также окислительно-восстановительным потенциалом реагирующих веществ и условиями окружающей среды.
Практическое применение образования солей при производстве материалов и лекарств

Образование солей, являющееся результатом взаимодействия металлов с кислотами, имеет широкое практическое применение при производстве материалов и лекарств. Соли могут быть использованы в различных отраслях промышленности, таких как химическая, фармацевтическая, пищевая и другие.
В материаловедении образование солей применяется для получения различных типов материалов, включая пигменты для красок, керамические материалы, стекла и прочие. Например, оксид железа, полученный из соли железа, используется для производства красок и покрытий.
В фармацевтической промышленности образование солей играет важную роль при создании лекарств. Многие лекарственные препараты представляют собой соли, которые образуются из активного вещества и кислоты. Образование солей позволяет улучшить химическую стабильность препарата, его растворимость и биодоступность, что способствует эффективности лекарства при лечении различных заболеваний.
Также образование солей имеет практическое значение в пищевой промышленности. Многие добавки пищевых продуктов являются солями, которые придают им определенные свойства. Например, соли кальция могут использоваться в пищевых продуктах для укрепления костей и зубов, а соли железа – для борьбы с анемией.
Таким образом, образование солей является важным и широко применяемым процессом при производстве материалов и лекарств. Оно позволяет получать различные виды материалов с нужными свойствами и разрабатывать эффективные и безопасные лекарственные препараты.
Вопрос-ответ

Каким образом происходит взаимодействие металлов с кислотами?
Взаимодействие металлов с кислотами происходит через образование солей. Когда металл вступает в реакцию с кислотой, происходит обмен ионами: металлический катион замещается на катион водорода. Таким образом, образуется соль металла и вода.
Какие соли образуются при взаимодействии металлов с кислотами?
При взаимодействии металлов с кислотами образуются соли металлов. Например, при реакции магния с соляной кислотой образуется хлорид магния (MgCl2), а при реакции меди с серной кислотой образуется сульфат меди (CuSO4). Формула соли зависит от конкретной кислоты и металла, участвующих в реакции.
