Оксиды щелочных металлов — это соединения, состоящие из атомов щелочных металлов и кислорода. Они являются основными оксидами, так как при реакции со водой образуют сильные основания — гидроксиды щелочных металлов.
Формулы оксидов щелочных металлов определяются их химическими свойствами и электрохимическим потенциалом. Каждый щелочной металл имеет свою уникальную формулу оксида. Например, формула оксида натрия — Na2O, оксида калия — К2O и так далее.
Химический состав и свойства оксидов щелочных металлов определяют их роль в различных процессах. Оксиды щелочных металлов широко применяются в промышленности, медицине и других областях. Они используются в производстве стекла, мыла, щелочных батарей, керамики и других веществ. Оксиды щелочных металлов также применяются в качестве катализаторов и в сельскохозяйственных процессах.
Оксиды щелочных металлов: что это такое?
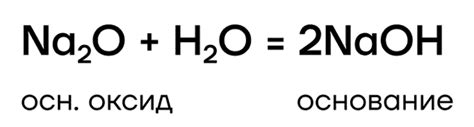
Оксиды щелочных металлов представляют собой химические соединения, состоящие из атомов щелочных металлов и кислорода. Щелочные металлы включают в себя такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs).
Оксиды щелочных металлов обладают определенными химическими свойствами. Они обычно являются твердыми веществами, хорошо растворимыми в воде и реагируют с кислородом, кислотами и некоторыми другими веществами. Большинство оксидов щелочных металлов обладает щелочными свойствами и может реагировать с кислотами, образуя соли и воду.
Оксиды щелочных металлов широко используются в различных областях. Например, оксид натрия (Na2O) и оксид калия (K2O) используются в производстве стекла и эмалей. Оксиды щелочных металлов также можно найти в составе многих минералов и горных пород, и они являются важными составляющими в почве.
В заключение, оксиды щелочных металлов представляют собой химические соединения, которые играют важную роль в нашей жизни. Они имеют своеобразные свойства и находят применение в различных сферах, от промышленности до геологии.
Функции и свойства оксидов щелочных металлов

Оксиды щелочных металлов обладают рядом функций и свойств, которые делают их важными соединениями в химической промышленности и научных исследованиях. Вот некоторые из них:
- Основные свойства: Оксиды щелочных металлов являются сильными основаниями. Они реагируют с кислотами, образуя соли и воду. Это основное свойство делает их полезными при нейтрализации кислотных растворов.
- Способность к гидролизу: Оксиды щелочных металлов могут гидролизироваться в воде, что приводит к образованию гидроксидов. Гидроксиды щелочных металлов имеют широкое применение в различных отраслях промышленности и научных исследованиях.
- Щелочные свойства: Оксиды щелочных металлов обладают выраженными щелочными свойствами, что делает их эффективными в щелочных процессах и реакциях.
- Электрохимические свойства: Оксиды щелочных металлов являются составной частью электролитов в различных электрохимических процессах. Они играют важную роль в электрохимических элементах и аккумуляторах.
- Способность к образованию структур и соединений: Оксиды щелочных металлов могут образовывать разнообразные структуры и соединения, такие как суперкристаллы, молекулярные комплексы и кластеры. Это делает их интересными для исследования и применения в различных областях науки и технологий.
В целом, оксиды щелочных металлов обладают уникальными функциями и свойствами, что делает их важными соединениями с множеством применений в различных отраслях промышленности и научных исследований.
Классификация оксидов щелочных металлов

Оксиды щелочных металлов - это соединения щелочных металлов с кислородом. Они образуются в результате химических реакций между щелочными металлами и кислородом воздуха.
Классификация оксидов щелочных металлов может быть основана на степени окисления щелочных металлов или на структуре их кристаллической решетки.
С точки зрения степени окисления, оксиды щелочных металлов можно разделить на две группы: оксиды с низкой степенью окисления и оксиды с высокой степенью окисления. Оксиды с низкой степенью окисления имеют формулу MO, где M - щелочной металл. Такие оксиды образуются при неполном сгорании металла в присутствии кислорода. Например, оксид натрия имеет формулу Na2O. Оксиды с высокой степенью окисления имеют формулу M2O или MO2. Они образуются при полном сгорании металла в кислороде. Например, оксид калия имеет формулу K2O, а оксид пероксида натрия имеет формулу Na2O2.
С дургой точки зрения, оксиды щелочных металлов могут быть подразделены на две главные группы: сольные и ковалентные связи. Оксиды с сольными связями обладают ионной структурой и обычно растворяются в воде, образуя щелочные растворы. Оксиды с ковалентными связями образуют ковалентные соединения и обычно не растворяются в воде. Например, оксид натрия (Na2O) является оксидом с сольными связями, в то время как оксид серы (SO2) является оксидом с ковалентными связями.
Таким образом, классификация оксидов щелочных металлов основана на различных аспектах, включая степень окисления и структуру связей в их кристаллической решетке. Это позволяет нам лучше понять их химические свойства и применение в различных областях науки и техники.
Применение оксидов щелочных металлов в различных отраслях

Оксиды щелочных металлов широко применяются в различных отраслях нашей жизни. Они играют важную роль в процессах производства, преследуют различные цели и находят применение в разных областях.
Одно из основных применений оксидов щелочных металлов – производство стекла. Содержание легких щелочных оксидов, таких как оксид натрия и оксид калия, способствует снижению температуры плавления, улучшает плавность стекла и придает ему прозрачность. Кроме того, оксиды щелочных металлов служат связующими веществами и способствуют образованию прочного стеклянного материала.
В отрасли строительства также широко используется применение оксидов щелочных металлов. Они являются одним из основных компонентов цемента и бетона. Оксиды калия и натрия улучшают свойства цементного раствора, обеспечивая его прочность и устойчивость, а также улучшают связь между различными составляющими бетона.
Оксиды щелочных металлов также находят применение в производстве жидкостей для охлаждения электронных компонентов, таких как процессоры, чипы и другие элементы компьютеров и электроники. Они обладают высокой теплопроводностью, благодаря чему способны отводить тепло от нагреваемых компонентов, предотвращая их перегрев.
Также оксиды щелочных металлов широко используются в производстве жидкостей для аккумуляторов. Они обеспечивают хорошую проводимость электричества и улучшают работу аккумулятора. Оксиды натрия и калия входят в состав растворов для заряда и поддержания работоспособности аккумуляторов различного назначения.
Таким образом, оксиды щелочных металлов являются неотъемлемой частью многих отраслей и играют важную роль в процессах производства различных материалов и изделий. Их свойства способствуют улучшению качества конечного продукта и повышению эффективности использования различных ресурсов.
Вопрос-ответ

Что такое оксиды щелочных металлов?
Оксиды щелочных металлов - это соединения, образованные щелочными металлами и кислородом. Они обладают высокой химической активностью и используются в различных промышленных процессах.
Какие формулы оксидов щелочных металлов существуют?
Существует несколько формул оксидов щелочных металлов. Например, оксид натрия имеет формулу Na2O, оксид калия - KO2, оксид лития - Li2O и т.д. Формулы зависят от атомной массы и электрохимических свойств каждого металла.
Какие свойства имеют оксиды щелочных металлов?
Оксиды щелочных металлов обладают некоторыми общими свойствами. Например, они являются основаниями и реагируют с кислотами, образуя соли и воду. Они также могут быть использованы как сильные окислители и находят применение в производстве стекла, щелочей и керамики.
Какова роль оксидов щелочных металлов в химических реакциях?
Оксиды щелочных металлов играют важную роль во многих химических реакциях. Они могут служить как окислителями, так и восстановителями, в зависимости от условий реакции. Они также могут реагировать с различными веществами, включая кислород, воду, кислоты и основания.
