Электродный потенциал на границе металл-раствор является одной из основных характеристик химических процессов, происходящих на поверхности металла в растворе. Этот потенциал, также известный как потенциал электрода или электрокинетический потенциал, возникает в результате переноса электронов между фазами металла и раствора. Он играет важную роль в различных электрохимических процессах, таких как электролиз, гальваническая коррозия, электроосаждение и другие.
Возникновение электродного потенциала на границе металл-раствор обусловлено различием в электрохимической активности металла и растворимых веществ в растворе. Металл обладает своими химическими свойствами, такими как потенциал окислительно-восстановительных реакций и концентрация электролитов. Для каждого металла характерен свой уровень энергии, что определяет его активность в химических реакциях.
На границе металл-раствор происходят редокс-реакции, то есть окислительно-восстановительные реакции, в результате которых на поверхности металла образуется электрический заряд. Такой заряд формирует электрическую двойную прослойку, состоящую из двух слоев – слоя ионов раствора и слоя заряженных атомных групп на поверхности металла. Эта электрическая двойная прослойка генерирует электрическое поле вокруг электрода, что и создает электродный потенциал.
Возникновение электродного потенциала
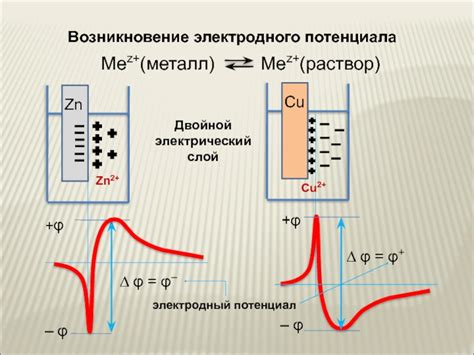
Возникновение электродного потенциала на границе металл-раствор связано с переносом заряда через эту границу. Когда металл погружают в раствор, на его поверхности происходит окисление или восстановление металлических ионов. В результате этого процесса, возникает неравновесное распределение зарядов на поверхности металла, что приводит к образованию электродного потенциала.
Электродный потенциал является мерой энергии, необходимой для перемещения заряда от металла в раствор или наоборот. Величина электродного потенциала определяется разностью концентраций ионов на границе металл-раствор, а также разностью активностей этих ионов в растворе и на поверхности металла.
Образование электродного потенциала является результатом динамического равновесия между реакциями окисления и восстановления, которые происходят на поверхности металла. Этот процесс обусловлен различной скоростью окисления и восстановления металлических ионов в растворе и на поверхности металла и называется электрохимической реакцией.
Электродный потенциал на границе металл-раствор является основным параметром, характеризующим электрохимические процессы. Измерение этого потенциала позволяет определить активность ионов в растворе, концентрацию металлических ионов на поверхности металла, а также степень окисления и восстановления металла.
Сущность электродного потенциала

Электродный потенциал - это особый параметр, который возникает на границе металл-раствор и является результатом разделения зарядов и формирования электрического поля. Он характеризует разницу потенциалов между металлом и раствором.
Электродный потенциал обусловлен тем, что металлы содержат свободные электроны, которые могут свободно двигаться внутри металлической структуры. При контакте металла с раствором происходит передача электронов между ними, что вызывает возникновение электродного потенциала.
Электродный потенциал имеет важное значение в электрохимических процессах, таких как коррозия, электролиз, гальваническая покраска и др. Он является ключевым параметром для определения термодинамической стабильности металла в растворе и может быть измерен при помощи электродов разных материалов.
Каждому металлу соответствует свой электродный потенциал, который может быть измерен в отношении стандартного электрода, такого как водородный электрод. Разница электродных потенциалов между двумя металлами может привести к возникновению гальванической пары, что позволяет использовать этот эффект для получения электрической энергии.
В заключение, электродный потенциал - это физическая величина, которая связана с разделением зарядов на границе металл-раствор. Он играет важную роль в электрохимических процессах и может быть измерен при помощи специальных электродов.
Механизм образования электродного потенциала
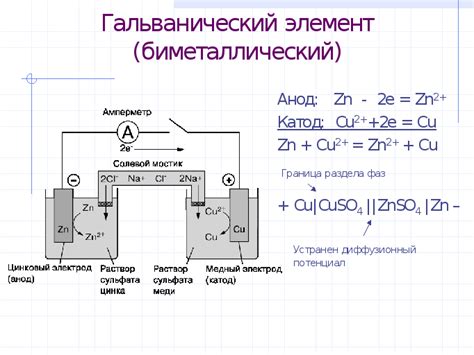
Электродный потенциал возникает на границе металл-раствор в результате разделения зарядов и диффузии ионов. Данный процесс обусловлен особенностями взаимодействия металла и раствора, а также различиями в концентрациях ионов на обеих сторонах границы.
На границе металл-раствор происходит процесс окисления и восстановления. При контакте с раствором на поверхности металла образуется слой активированной воды, которая способна разлагаться на положительные и отрицательные ионы. Это приводит к образованию двух электродов: анода и катода.
На аноде происходит окислительно-восстановительные реакции, в результате которых металл переходит в состояние окисления и образует положительные ионы. Эти положительные ионы распространяются в растворе и замещают оттуда другие положительные ионы, которые мигрируют к металлу и отрицательному электроду.
С другой стороны, на катоде происходит обратный процесс: положительные ионы из раствора электролита приходят к катоду и осаждаются в виде отрицательных ионов на поверхности металла. После этого эти отрицательные ионы также мигрируют в раствор и замещают другие отрицательные ионы, формируя таким образом положительную заряду на поверхности металла.
Таким образом, разделение зарядов на границе металл-раствор обусловлено движением ионов из раствора на поверхность металла и обратно. В результате этих процессов возникает электродный потенциал, который может быть измерен и использован для различных практических целей, например, в электрохимических системах или в аналитической химии.
Влияние металла на образование электродного потенциала

Электродный потенциал является важной характеристикой, описывающей взаимодействие между металлом и раствором. Влияние металла на образование электродного потенциала определяется несколькими факторами.
Во-первых, химический состав металла играет ключевую роль. Различные металлы имеют разные свойства и реактивность, что влияет на их взаимодействие с раствором. Например, активные металлы, такие как цинк или алюминий, могут образовывать электродный потенциал более энергично, чем пассивные металлы, такие как золото или платина. Это связано с их способностью активно реагировать с раствором и образовывать ионы.
Во-вторых, поверхностные свойства металла также оказывают влияние на образование электродного потенциала. Факторы, такие как рельеф поверхности, наличие пленки оксида или другого покрытия, могут привести к изменению поверхностного состава металла и, соответственно, к изменению его реактивности.
В-третьих, концентрация раствора играет свою роль в образовании электродного потенциала. Более высокая концентрация раствора может способствовать активному взаимодействию с поверхностью металла и образованию большего количества ионов, что в конечном итоге приводит к более высокому значению электродного потенциала.
В-четвертых, температура также может оказывать влияние на образование электродного потенциала. Повышение температуры может способствовать активации химических реакций, что повлечет за собой изменение электродного потенциала.
В зависимости от всех перечисленных факторов, образуется определенное значение электродного потенциала на границе металл-раствор. Изучение и понимание влияния металла на образование электродного потенциала не только важно для практического применения в различных областях, но и помогает лучше понять физико-химические процессы, происходящие на границе раздела металл-раствор.
Роль раствора в формировании электродного потенциала

Электродный потенциал на границе металла и раствора играет важную роль при электрохимических процессах. Он возникает вследствие разности концентрации и активности ионов в растворе и на поверхности металла.
Раствор играет активную роль в формировании электродного потенциала. В некоторых случаях, электродный потенциал образуется в результате окислительно-восстановительных процессов, которые происходят в растворе. Раствор может содержать редокс пару, где один компонент окисляется, а другой восстанавливается.
Присутствие раствора также оказывает влияние на реакциях происходящих на поверхности металла. Этот факт является причиной возникновения дополнительного электродного потенциала на границе металл-раствор.
Физико-химические свойства раствора также влияют на электродный потенциал. Например, pH раствора может изменять электродный потенциал, так как влияет на активность ионов и их концентрацию. Кроме того, раствор может содержать различные добавки, которые специально добавляются для формирования определенного электродного потенциала.
Таким образом, роль раствора в формировании электродного потенциала заключается в том, что он обеспечивает необходимые условия для происходящих на границе металл-раствор электрохимических реакций, а также влияет на физико-химические свойства ионов, концентрацию и активность, что в свою очередь определяет уровень электродного потенциала.
Электродный потенциал и электрохимические процессы
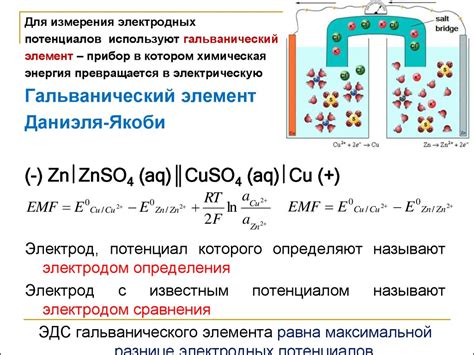
Электродный потенциал является одной из важнейших характеристик при изучении электрохимических процессов. Он определяет возможность перехода электронов от одного электрода к другому, а также позволяет оценить скорость и направление реакции.
Электрохимические процессы в основном происходят на границе металл-раствор, где электродный потенциал возникает под влиянием разности концентраций или активностей веществ, их степени окисления, температуры и других факторов. В результате этих процессов происходят окислительно-восстановительные реакции и образуются электролитическии или гальванические элементы.
Разница в электродном потенциале электродов определяется их химическими свойствами. Наибольший электродный потенциал имеет вещество, способное приобрести положительный заряд, и наоборот, наименьший электродный потенциал имеет вещество, способное приобрести отрицательный заряд. Таким образом, электродный потенциал позволяет оценить приоритетность окислительно-восстановительных процессов и выбрать самую эффективную электрохимическую систему.
Одним из способов определения электродного потенциала является ионный выброс. При иехневтическом контакте металлического электрода со средой образуется двойной ионный слой, состоящий из положительно и отрицательно заряженных ионов. Инициировать данный процесс можно путем погружения металлического электрода в раствор с ионами электролита. Этот метод позволяет измерить разность потенциалов между металлом и раствором и тем самым определить его электродный потенциал.
Применение электродного потенциала в технике и науке

1. Электрохимическая коррозия металлов.
Электродный потенциал играет важную роль в понимании и предотвращении электрохимической коррозии металлов. При контакте различных металлов с растворами электролитов образуются гальванические элементы, в которых возникает потенциал. Знание и контроль электродного потенциала позволяет прогнозировать и предотвращать коррозию, что является важным в технике и промышленности.
2. Электрохимические процессы в аккумуляторах.
Аккумуляторы, или аккумуляторные батареи, основаны на электрохимических процессах, связанных с электродными потенциалами. В аккумуляторах происходит преобразование химической энергии в электрическую и наоборот. Знание потенциалов электродов позволяет выбирать оптимальные материалы для электродов и улучшать работу аккумуляторов в различных устройствах и системах.
3. Определение рН-уровня растворов.
Электродный потенциал также используется для определения рН-уровня растворов. Для этого используются электроды, имеющие разные потенциалы при взаимодействии с растворами разной кислотности. По разности потенциалов между разными электродами можно определить концентрацию водородных и гидроксильных ионов, что позволяет определить рН-уровень и химическую активность растворов.
4. Электрофизиология и нейронаука.
В электрофизиологии и нейронауке электродный потенциал играет фундаментальную роль в изучении электрической активности клеток и нервной системы в целом. С помощью электродов можно измерять и регистрировать электрические сигналы, возникающие в клетках и нейронах. Это позволяет исследовать механизмы работы нервной системы, изучать электрические сигналы, возникающие при различных физиологических и патологических состояниях, и разрабатывать новые методы диагностики и терапии.
5. Технологии электроосаждения и гальванического покрытия.
Применение электродного потенциала находит широкое применение в технологиях электроосаждения и гальванического покрытия. В этих процессах с использованием электродного потенциала происходит осаждение металлических покрытий на поверхности различных материалов. Это позволяет улучшать защитные свойства материалов, создавать эстетически привлекательные покрытия, а также применять методы электроосаждения в различных отраслях промышленности, включая медицину, электронику и автомобильную промышленность.
Вопрос-ответ

Почему возникает электродный потенциал на границе металл-раствор?
На границе металл-раствор возникает электродный потенциал из-за разности электрохимических свойств металла и раствора.
Какая разница в электрохимических свойствах металла и раствора?
Металл обладает электронно-проводящими свойствами, тогда как раствор может быть электролитическим, содержащим различные ионы. Это создает разность в электрическом потенциале между металлом и раствором.
Какая роль играют ионы в возникновении электродного потенциала?
Ионы в растворе обладают зарядом и двигаются вокруг металла под влиянием электрического поля, создаваемого металлом. Это создает электрическую двухслойную структуру на границе металл-раствор, что приводит к возникновению электродного потенциала.
Что происходит при установлении электродного потенциала на границе металл-раствор?
При установлении электродного потенциала на границе металл-раствор происходит перераспределение зарядов и ионов, чтобы совершались электрохимические реакции с минимальным потенциальным барьером. Это позволяет поддерживать стабильное состояние системы.
