Щелочные металлы 1 группы периодической системы элементов - это литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих элементов есть особенность - в своих соединениях они всегда имеют положительное значение окисления.
Наиболее распространены степени окисления +1, но у некоторых щелочных металлов возможны и другие значения. Например, литий может иметь степень окисления +2, натрий и калий - +2 и +4. Однако степень окисления +1 преобладает в их соединениях.
Степень окисления щелочных металлов в основном зависит от их электроотрицательности и валентности. Более электроотрицательные элементы способны принимать электроны от меньшей электроотрицательности и получать положительную степень окисления. Например, в соединении натрий хлорид (NaCl) натрий имеет степень окисления +1, поскольку он отдает один электрон хлору, который имеет большую электроотрицательность.
Важно отметить, что для щелочных металлов высшие степени окисления, включая ненормальные степени окисления, редки и малоизучены.
Знание степеней окисления щелочных металлов важно для определения состава и свойств различных соединений и для понимания их реакций. Это также может быть полезно для создания новых соединений и использования их в различных областях, включая химическую промышленность, исследования и медицину.
Окисление и восстановление щелочных металлов
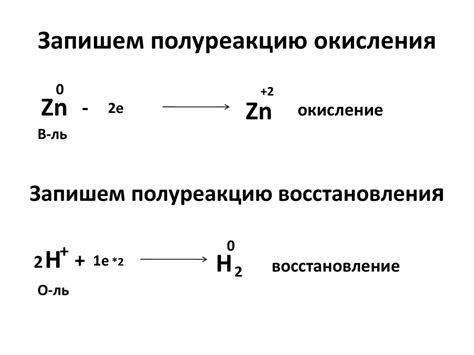
Окисление и восстановление щелочных металлов – это химические реакции, которые характеризуются изменением степени окисления этих элементов. Щелочные металлы, такие как литий, натрий, калий и др., обладают одноименным свойством окислительной активности.
Окисление щелочных металлов представляет собой реакцию их ионов с веществами, взаимодействующими с ними, при которой металл теряет электроны и его степень окисления возрастает. Такие реакции могут происходить с кислородом, хлором, фтором, серой, и другими окислителями.
Восстановление щелочных металлов, напротив, является процессом, при котором ионы металла принимают электроны и его степень окисления уменьшается. Такие реакции происходят среди прочего при взаимодействии металлов с кислотами, галогенами, некоторыми неорганическими соединениями и органическими веществами.
Окисление и восстановление щелочных металлов имеют большое практическое значение и находят свое применение в различных отраслях науки и техники. Например, в реакциях окисления щелочных металлов выделяется энергия, которая используется в производстве батарей и аккумуляторов, а также в реактивных двигателях и солнечных батареях. Восстановление щелочных металлов применяется в гальваническом разделении веществ, в синтезе органических соединений и в процессах выделения металлов из руд.
Сущность процесса высших степеней окисления
Высшие степени окисления веществ являются результатом реакций окисления, в которых атомы металла теряют больше электронов, чем в обычных окислительно-восстановительных реакциях. Это приводит к образованию оксидов, в которых атом металла имеет наиболее положительное значение степени окисления.
Процесс высших степеней окисления обладает особой значимостью в химии щелочных металлов 1 группы. Он позволяет получать оксиды, которые находят широкое применение в различных отраслях промышленности и научных исследованиях.
Степень окисления щелочных металлов в оксидах определяется по отношению к кислороду, который обладает степенью окисления -2. Так, в оксидах щелочных металлов в степени окисления соответствует их заряду. Например, в оксиде натрия (Na2O) натрий имеет степень окисления +1, а в оксиде калия (K2O) калий - +1.
Процесс высших степеней окисления имеет важное значение не только с точки зрения химических свойств, но и с практической стороны. Оксиды могут быть использованы в производстве стекла, керамики и других материалов, а также в процессах катализа и синтезе органических соединений.
Щелочные металлы и их особенности в окислительно-восстановительных реакциях

Щелочные металлы – это элементы 1 группы периодической системы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Щелочные металлы обладают рядом особенностей в окислительно-восстановительных реакциях, что делает их важными веществами для промышленных и лабораторных процессов.
Основной характеристикой щелочных металлов является их низкое значение электроотрицательности. Это означает, что они легко отдают электроны другим элементам, что способствует их активности в окислительно-восстановительных реакциях. Благодаря этой особенности щелочные металлы являются хорошими восстановителями и окислителями.
В основном, щелочные металлы вступают в реакцию с кислородом, образуя основные оксиды. Например, натрий при реакции с кислородом образует оксид натрия (Na2O) или пероксид натрия (Na2O2). Эти вещества активно используются в промышленности, например, для производства стекла и щелочи.
Однако, щелочные металлы также могут вступать в реакцию с другими элементами и соединениями. Например, они реагируют с водой, образуя соответствующие гидроксиды и высвобождая водород. Это реакция, которая происходит с выделением тепла и характерна для всех щелочных металлов.
Также, щелочные металлы могут вступать в реакцию с кислотами, образуя соответствующие соли. Например, реакция натрия с хлороводородной кислотой приводит к образованию хлорида натрия и выделению водорода. Это реакция окисления натрия, в результате которой происходит образование соединения с более высокой степенью окисления.
Вопрос-ответ

Каковы основные степени окисления щелочных металлов 1 группы?
Основными степенями окисления щелочных металлов 1 группы (литий, натрий, калий) являются +1 и 0.
Какие ионы образуют щелочные металлы 1 группы при окислении?
При окислении щелочные металлы 1 группы образуют ионы с положительным зарядом, а именно ионы +1, которые являются катионами.
Каково значение окислительной способности щелочных металлов 1 группы?
Щелочные металлы 1 группы обладают высокой окислительной способностью из-за низкой энергии ионизации и большого радиуса иона.
Может ли степень окисления щелочных металлов 1 группы быть отрицательной?
Степень окисления щелочных металлов 1 группы не может быть отрицательной, так как они образуют ионы с положительным зарядом.
