Металлы являются важными элементами, потому что они имеют множество полезных свойств. Одним из них является способность металлов взаимодействовать с кислотами. Когда металл контактирует с кислотой, происходит химическая реакция, в результате которой образуется соль и выделяется водород. Это взаимодействие может протекать с различной интенсивностью в зависимости от типа металла и кислоты.
Особенности химических реакций между металлами и кислотами объясняются их электрохимическими свойствами. Металлы имеют низкую ионизационную энергию, что позволяет им отдавать электроны, образуя катионы. Кислоты, в свою очередь, обладают высокой электроотрицательностью, что способствует принятию электронов от металла. Таким образом, металлы и кислоты могут образовывать ионы, которые затем соединяются, образуя соли.
Важно отметить, что разные металлы взаимодействуют с кислотами по-разному. Некоторые металлы, такие как цинк и железо, могут растворяться в кислотах, образуя соответствующие соли и выделяя большое количество водорода. Другие металлы, такие как алюминий и цинк, образуют пассивную пленку на своей поверхности при контакте с кислотой, что предотвращает дальнейшее взаимодействие.
Это взаимодействие металлов с кислотами нашло свое практическое применение в различных отраслях промышленности. Например, металлы используются в процессе производства батарей, где реакция металла с кислотой создает электрическую энергию. Кроме того, взаимодействие металлов с кислотами может использоваться для удаления окисленных пятен и загрязнений на поверхности металлических предметов.
Металлы и их взаимодействие с кислотами
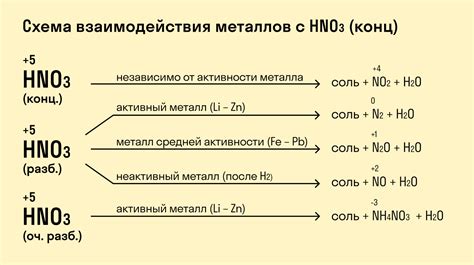
Металлы проявляют особые химические свойства при взаимодействии с кислотами. Они могут действовать как щелочные или амфотерные вещества, способные нейтрализовать кислотные растворы или образовывать с ними соли.
Во время взаимодействия с кислотами металлы могут проявлять химические реакции различного типа. Например, некоторые металлы, такие как натрий, калий и магний, реагируют с кислородом из кислоты, образуя оксиды металла и воду. Другие металлы, такие как железо или цинк, могут реагировать с водородом из кислоты, выделяя его в виде газа.
Взаимодействие металлов с кислотами находит широкое практическое применение. Например, в химической промышленности металлы используются для производства солей, которые являются важными реагентами для многих процессов. Кроме того, эта реакция может быть использована для очистки металлической поверхности от оксидов и нагара.
Следует отметить, что при взаимодействии металлов с кислотами необходимо учитывать конкретные условия. Некоторые металлы, например, алюминий или цинк, могут реагировать с кислотами с выделением большого количества тепла и газов, что требует осторожности при проведении этих реакций.
Таким образом, взаимодействие металлов с кислотами представляет собой важный аспект химических реакций. Изучение этого взаимодействия позволяет строить новые химические соединения, а также находит практическое применение в различных сферах промышленности и научных исследований.
Уникальные свойства металлов в реакциях с кислотами

Металлы обладают рядом уникальных свойств, которые проявляются в реакциях с кислотами. Во-первых, металлы способны образовывать с кислотами соли. Соли металлов являются ионными соединениями, в которых положительные ионы металла связаны с отрицательными ионами кислоты.
Во-вторых, металлы могут реагировать с кислотами, освобождая водород. Эта реакция называется реакцией металла с кислородом. При этой реакции свободные атомы металла вступают в контакт с кислородом из кислоты и образуют оксиды металла. Водород, выделяющийся при этой реакции, может быть легко обнаружен с помощью горения или с помощью особых тестовых полосок.
Также, металлы могут быть эффективными катализаторами в реакциях с кислотами. Катализатор – это вещество, которое повышает скорость химической реакции, не участвуя в самой реакции. Металлы, благодаря своей химической активности, могут активировать молекулы кислоты и способствовать более быстрому протеканию реакции.
Однако, следует отметить, что не все металлы одинаково реагируют с кислотами. Некоторые металлы, такие как золото или платина, не реагируют с кислотами и считаются химически инертными. Другие металлы, такие как натрий или калий, реагируют очень активно и могут даже проявлять горючие свойства при контакте с кислотами.
В целом, свойства металлов в реакциях с кислотами зависят от их электрохимической активности, а также от химического состава и концентрации кислот.
Окислительные и восстановительные реакции металлов с кислотами

Металлы способны проявлять свои окислительные и восстановительные свойства при взаимодействии с кислотами. При контакте с кислотой происходит окисление металла, что приводит к образованию соли металла и выделению водорода.
Восстановительные свойства металлов основаны на их способности отдавать электроны, тем самым снижая степень окисления других элементов. Взаимодействие металла с кислотой приводит к образованию соответствующего вещества металла в более низкой степени окисления и выделению водорода.
Окислительные реакции металлов с кислотами протекают также на основе взаимодействия с электронами. В этом случае металл теряет электроны, а кислота принимает их, превращаясь в нейтральное вещество. При этом металл окисляется и образуются ионы металла в более высокой степени окисления.
Окислительные и восстановительные реакции металлов с кислотами являются основой для множества практических применений. Например, взаимодействие металлов с кислотами используется в процессе получения водорода в промышленности. Также металлические соединения из кислотных растворов могут использоваться в качестве катализаторов или в процессах синтеза органических соединений.
Металлы и реакции кислот с основаниями
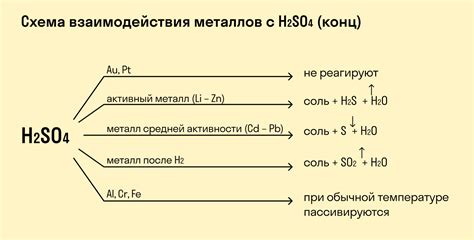
Металлы играют важную роль в реакциях кислот с основаниями. Они могут быть использованы в качестве катализаторов или активных участников химических процессов. Кислоты и основания могут образовывать с металлами различные соединения, такие как соли и гидроксиды.
Реакция кислоты с основанием, известная как нейтрализация, приводит к образованию соли и воды. Металлы часто выступают в качестве оснований и реагируют с кислотами, образуя соли металлов. Например, реакция железа с соляной кислотой приводит к образованию соли железа и выделению водорода.
Металлы также могут быть использованы в качестве катализаторов для реакции кислоты с основанием. Катализаторы ускоряют химические реакции, не участвуя сами в реакции. Например, платиновый катализатор может ускорить реакцию между водородом и кислородом при образовании воды.
Практическое применение реакций металлов с кислотами и основаниями широко распространено. Например, соли металлов используются в медицине, сельском хозяйстве и промышленности. Они могут использоваться как удобрения, катализаторы или вещества для получения специфических химических соединений.
Таким образом, реакции металлов с кислотами и основаниями являются важными процессами, которые имеют практическое применение в различных областях. Они позволяют получать разнообразные химические соединения и ускорять химические реакции, что делает их значимыми для науки и промышленности.
Практическое применение взаимодействия металлов с кислотами

Взаимодействие металлов с кислотами имеет широкое практическое применение в различных областях. Одним из наиболее распространенных примеров является использование реакции между металлами и кислотами в химической промышленности.
Металлы могут служить катализаторами в химических реакциях, активно участвуя в переносе электронов и образовании промежуточных соединений. Например, реакция между железом и серной кислотой используется для получения водорода. Железо при взаимодействии с кислотой выделяет водородный газ, который может быть использован как источник энергии или в процессах синтеза различных веществ.
Другой пример применения взаимодействия металлов с кислотами – это процесс гальванического покрытия. При этом металл наносится на поверхность другого металла путем электрохимического осаждения. Основой данного процесса является реакция между металлом и кислотой, которая осуществляется в электролите. Таким образом, гальваническое покрытие позволяет защитить поверхность металла от коррозии, придать ей презентабельный вид или изменить некоторые его свойства, такие как твердость или стойкость к истиранию.
Взаимодействие металлов с кислотами также имеет место в медицине. Некоторые металлы и их соединения обладают антисептическими и противовоспалительными свойствами. Например, раствор серебра в нитратной кислоте используется в качестве антимикробного препарата. Добавление серебра в кислоту позволяет повысить ее бактерицидные свойства и эффективность в борьбе с инфекциями.
Таким образом, взаимодействие металлов с кислотами имеет широкое практическое применение в различных областях. Отличная химическая активность металлов и их соединений позволяет использовать их в разнообразных процессах, таких как получение водорода, гальваническое покрытие и медицинские применения.
Применение металлов для нейтрализации кислот

Металлы широко используются для нейтрализации кислотных растворов во многих областях жизни и научных исследований. Будучи основами, они обладают способностью взаимодействовать с кислотами и образовывать соли и воду.
Одним из наиболее часто применяемых металлов для нейтрализации кислот является гидроксид натрия (NaOH). Он используется в химической, пищевой и фармацевтической промышленности для регулирования pH растворов и нейтрализации кислот поскольку разлагается на ион натрия (Na+) и ион гидроксида (OH-), которые реагируют с кислотами.
Как пример, цинк (Zn) используется для нейтрализации серной кислоты (H2SO4). Реакция, инициируемая цинком, приводит к образованию соли цинка (ZnSO4) и выделению водорода (H2).
- Золото (Au) может также использоваться для нейтрализации кислот. Реакция золота с соляной кислотой (HCl) приведет к образованию золотой соли (AuCl3) и выделению хлора (Cl2).
- Алюминий (Al) химически реагирует с соляной кислотой (HCl) и солями некоторых других кислот, образуя алюминий хлорид (AlCl3) и выделяя водород (H2).
- Магний (Mg) используется для нейтрализации соляной кислоты (HCl). Реакция с магнием приводит к образованию магниевого хлорида (MgCl2) и выделению водорода (H2).
Практическое применение этих реакций заключается в том, что металлы могут быть использованы для нейтрализации отходов и очистки загрязненных вод. Они также играют важную роль в производстве батареек, где металлические электроды реагируют с кислотными электролитами для создания электрической энергии.
Таким образом, применение металлов для нейтрализации кислот является неотъемлемой частью химических процессов и имеет широкий спектр применения в различных областях. Эти реакции основаны на химической реактивности металлов и их способности взаимодействовать с кислотами для образования солей и воды.
Значение взаимодействия металлов с кислотами в научных и промышленных целях

Исследования
Взаимодействие металлов с кислотами является важной темой исследований в области химии и материаловедения. Ученые изучают различные аспекты этого процесса, включая кинетику реакции, механизмы образования соединений, структурные и электронные свойства полученных продуктов.
Формирование соединений
Взаимодействие металлов с кислотами приводит к образованию различных соединений, которые могут иметь важные свойства и широкий спектр применений. Например, образование солей металлов и кислот является основой для получения различных химических соединений, используемых в качестве катализаторов, пигментов, проводников, керамических материалов и т.д.
Контроль кислотности
Взаимодействие металлов с кислотами применяется для контроля кислотности в различных средах. Например, добавление металлических порошков или сплавов в кислотные растворы позволяет регулировать и поддерживать определенный уровень pH. Это особенно важно в промышленных процессах, где поддержание определенной кислотности может быть критическим для эффективности процесса и предотвращения образования нежелательных осадков или коррозии.
Производство металлических соединений
Взаимодействие металлов с кислотами играет важную роль в производстве металлических соединений. Кислотные растворы могут использоваться для растворения и очистки металлов, а затем полученные растворы могут быть обработаны для получения необходимых металлических соединений, таких как соли металла или его оксиды. Эти соединения, в свою очередь, могут быть использованы в различных отраслях промышленности, включая электронику, медицину, энергетику и другие.
Вопрос-ответ

Как металл влияет на кислоту?
Металл может влиять на кислоту различными способами. Например, реакция металла с кислотой может производить соль и выделяться водород. Также, некоторые металлы могут катализировать реакции кислоты. Образование солей металлами может изменять свойства кислоты, такие как ее кислотность и растворимость.
Какие металлы реагируют с кислотами?
Реакция металлов с кислотами будет происходить только в том случае, если соответствующая реакция будет энергетически выгодной. Наиболее активными металлами являются щелочные и щелочноземельные металлы, такие как натрий, калий, магний, кальций. Они растворяются в кислотах с образованием солей и выделением водорода.
