Оксиды металлов – это соединения металлов с кислородом, которые могут быть восстановлены водородом. Это свойство базируется на высокой реакционной способности водорода и его способности снижать окислительную способность оксидов. Восстановление оксидов металлов водородом может иметь различные применения, такие как получение металлов, каталитические реакции и другие процессы.
Водород способен восстанавливать множество оксидов металлов, таких как оксид железа (FeO), оксид меди (CuO), оксид цинка (ZnO) и другие. При этом оксиды металлов претерпевают реакцию, в результате которой образуются элементарные металлы и вода.
Полный список оксидов металлов, восстанавливаемых водородом, включает, помимо уже перечисленных, такие соединения, как оксид алюминия (Al2O3), оксид никеля (NiO), оксид свинца (PbO), оксид кобальта (CoO) и многие другие. Каждый из них имеет свои особенности и применения, которые делают их важными в различных областях науки и промышленности.
Методы восстановления оксидов металлов водородом

Восстановление оксидов металлов водородом является важным и широко применяемым методом в химической промышленности. Это процесс, при котором оксиды металлов превращаются обратно в металлы путем взаимодействия с молекулами водорода.
Один из основных методов восстановления оксидов металлов водородом - это гидрогенирование. При этом процессе оксиды металлов взаимодействуют с водородом под воздействием определенных условий, таких как температура и давление. Гидрогенирование используется для получения металлического металлолома или руды, а также в процессе производства различных химических соединений.
Еще одним методом восстановления оксидов металлов водородом является каталитическое восстановление. При этом процессе оксиды металлов взаимодействуют с водородом в присутствии специального катализатора, который ускоряет химическую реакцию. Каталитическое восстановление широко применяется в производстве различных органических и неорганических соединений, включая промышленное восстановление оксидов металлов.
Также существует метод электрохимического восстановления оксидов металлов водородом. В этом случае оксиды металлов преобразуются в металлы под воздействием электрического тока, пропущенного через раствор восстановителя с водородом. Электрохимическое восстановление широко применяется в гальванической промышленности и в производстве электродов для различных электрохимических процессов.
Оксиды щелочных металлов, восстанавливаемые водородом

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, образуют оксиды, которые могут быть восстановлены водородом. Эти оксиды обладают важными свойствами и широко применяются в различных отраслях промышленности.
Восстановление оксидов щелочных металлов водородом происходит по реакции, в результате которой образуется соответствующий гидроксид металла. Это процесс, основанный на взаимодействии водорода с кислородом, образующим оксид, при высоких температурах.
Одним из наиболее распространенных примеров оксида щелочного металла, восстанавливаемого водородом, является оксид калия (K2O). При контакте с водородом в присутствии катализатора происходит реакция, в результате которой образуется гидроксид калия (KOH).
Оксиды щелочных металлов, восстанавливаемые водородом, находят применение в различных отраслях промышленности. Например, гидроксид калия используется в процессе производства щелочных батарей, в производстве стекла, керамики, а также в производстве удобрений и косметических средств.
Восстановление оксидов щелочных металлов водородом является важным процессом, который позволяет получить ценные продукты и использовать их в различных сферах деятельности. Главным результатом такого восстановления является образование гидроксидов, которые обладают уникальными свойствами и находят широкое применение в промышленности.
Оксиды щелочноземельных металлов, восстанавливаемые водородом
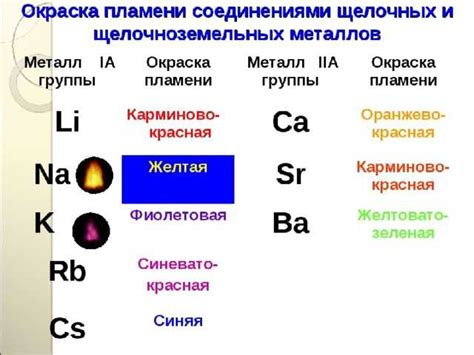
Оксиды щелочноземельных металлов, такие как оксид кальция, оксид магния и оксид бария, являются соединениями, которые могут быть восстановлены водородом.
Восстановление оксидов щелочноземельных металлов происходит путем реакции с водородом при определенной температуре и давлении. В результате этой реакции образуются гидроксиды соответствующих металлов и выделяется вода.
Процесс восстановления оксидов щелочноземельных металлов водородом имеет ряд применений. Например, этот процесс используется в промышленности для получения чистых металлических форм магния, кальция и бария. Восстановленные металлы имеют различные применения в различных отраслях, включая производство сплавов, литейные работы и производство специализированных материалов.
Восстановление оксидов щелочноземельных металлов водородом также может быть использовано в лаборатории для получения металлических препаратов и исследования свойств данных металлов. Этот процесс может быть интересен для ученых и студентов, изучающих химию и свойства металлов.
В целом, восстановление оксидов щелочноземельных металлов водородом является важным процессом, который имеет широкий спектр применений в промышленности и научных исследованиях.
Оксиды переходных металлов, восстанавливаемые водородом
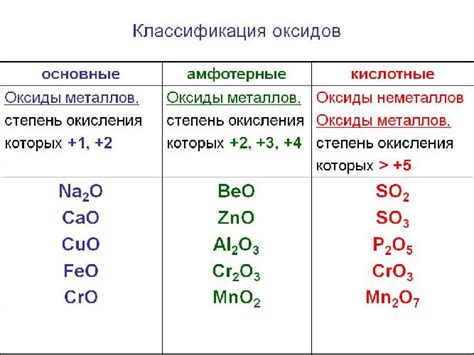
Оксиды переходных металлов относятся к классу химических соединений, которые можно восстановить водородом. Эти оксиды представляют собой соединения, состоящие из атомов металла, связанных с кислородом. Оксиды переходных металлов имеют различные свойства и применения в разных областях науки и техники.
Одним из примеров оксидов переходных металлов, восстанавливаемых водородом, является оксид железа (III) (Fe2O3), который также называется гематитом. Этот оксид имеет красно-коричневую окраску и широко используется в производстве стали, магнитов и красок. Водород может восстановить оксид железа (III) до металлического железа.
Другим примером такого оксида является оксид меди (II) (CuO), который называется также черным медным оксидом или купрумоксидом. Он обладает черным цветом и применяется в электронике, в производстве керамики и катализаторов. Водород способен восстановить оксид меди (II) до металлической меди.
Также стоит отметить оксиды переходных металлов, такие как оксид цинка (ZnO), оксид марганца (MnO) и оксид никеля (NiO), которые также могут быть восстановлены водородом. Они имеют различные свойства и применения, от производства батареек до использования в катализаторах и солнечных батареях.
Оксиды благородных металлов, восстанавливаемые водородом
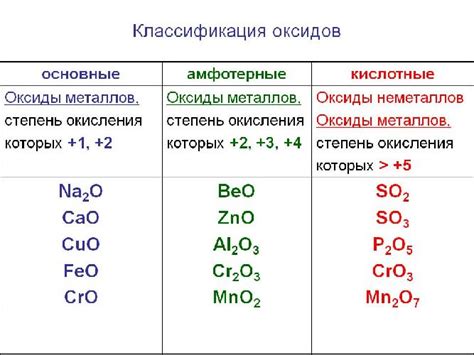
Оксиды благородных металлов представляют собой химические соединения, содержащие кислород и металл, который является благородным металлом. Они могут быть восстановлены воскресным водородом.
Список оксидов благородных металлов, восстанавливаемых водородом, включает:
- Оксид платины (PtO2) - оксид платины, который может быть восстановлен водородом для получения чистого металла платины.
- Оксид иридия (IrO2) - оксид иридия, который также может быть восстановлен водородом, чтобы получить металл иридий.
- Оксид родия (Rh2O3) - оксид родия, который может быть обратно восстановлен водородом для получения родия в его чистой форме.
- Оксид рутения (RuO2) - оксид рутения, который также можно восстановить водородом, чтобы получить рутений.
Восстановление этих оксидов водородом является процессом, который позволяет получить высокочистые металлы благородных металлов. Это очень важное свойство данных оксидов, которое находит применение в различных отраслях промышленности, включая производство электроники, катализ, медицину и другие.
Другие оксиды металлов, восстанавливаемые водородом
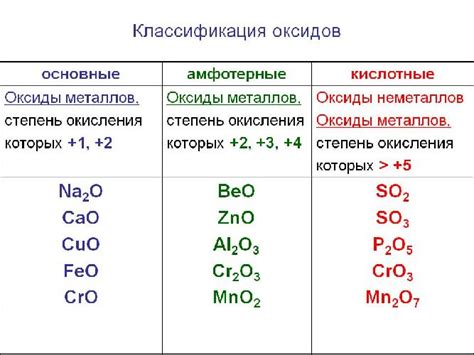
Помимо перечисленных выше оксидов металлов, существует и множество других оксидов, которые также могут быть восстановлены водородом. Вот некоторые из них:
- Оксид алюминия (Al2O3) - этот оксид металла также может быть восстановлен водородом. Он широко используется в производстве алюминия и его сплавов, а также в качестве катализатора.
- Оксид меди (Cu2O) - этот оксид металла обладает красным цветом и используется в производстве различных материалов, включая керамику и краски.
- Оксид цинка (ZnO) - этот оксид металла широко применяется в производстве резины, пластмасс, лакокрасочных материалов и солнцезащитных средств.
Также стоит отметить, что восстановление оксидов металлов водородом может быть одним из методов получения соответствующих металлов. Например, оксид железа (Fe3O4) может быть восстановлен водородом, что приводит к образованию чистого железа.
В целом, оксиды металлов, восстанавливаемые водородом, играют важную роль в различных отраслях промышленности и находят применение в производстве различных материалов и веществ. Их свойства и возможности восстановления делают их ценными и востребованными веществами.
Вопрос-ответ

Какие металлы образуют оксиды, которые можно восстановить водородом?
Список металлов, образующих оксиды, восстанавливаемые водородом, включает алюминий, цинк, никель, кадмий, железо и многие другие.
Для чего используется процесс восстановления оксидов металлов водородом?
Процесс восстановления оксидов металлов водородом применяется в различных областях, в том числе в обработке металлов, производстве водорода и очистке газов.
Какой механизм протекает при восстановлении оксидов металлов водородом?
Восстановление оксидов металлов водородом происходит за счет реакции между металлическим оксидом и водородом. Водород выступает в качестве восстановителя, а металлический оксид принимает на себя электроны, в результате чего происходит образование металла и воды.
Какие свойства имеют оксиды, восстанавливаемые водородом?
Свойства оксидов, восстанавливаемых водородом, зависят от конкретного металла. Некоторые из них обладают катализирующей активностью, другие могут использоваться в качестве пигментов или добавок для улучшения сцепления металла с другими материалами.
Какие примеры можно привести оксидов, восстанавливаемых водородом?
Примерами оксидов, которые можно восстановить водородом, являются оксид железа (Fe2O3), оксид цинка (ZnO), оксид никеля (NiO) и оксид алюминия (Al2O3).
