Оксид углерода 2, более известный как угарный газ, является одним из основных продуктов сгорания органических веществ. Обладая высокой токсичностью, данный газ способен вызывать серьезные проблемы со здоровьем, в том числе отравления и даже смерть. Однако, несмотря на это, угарный газ может быть также использован в качестве сильного восстановителя при взаимодействии с различными металлами.
Реакция металлов с углеродным оксидом 2 основана на том, что металлы способны "отдавать" свои электроны молекуле газа в процессе окисления. В результате образуется углекислый газ и металлокарбонат. Эта реакция в основном идет с теми металлами, у которых электронные оболочки слабо связаны и легко отдают электроны.
Список металлов, реагирующих с угарным газом, включает в себя: железо, никель, медь и марганец. Железо и никель, например, реагируют с углеродным оксидом 2 при нагреве до высоких температур. Медь и марганец также обладают способностью реагировать с угарным газом, но при нижних температурах.
Реакция металлов с угарным газом имеет широкое применение в промышленности и научных исследованиях. Например, угарный газ используется для обесцвечивания стекла при производстве оптических приборов. Также реакция угарного газа с металлами может быть использована для получения металлических сплавов, которые обладают особыми химическими и физическими свойствами. В целом, восстановление оксидом углерода 2 является интересной и практически значимой реакцией, которая находит применение в различных областях науки и промышленности.
Металлы, способные реагировать с оксидом углерода 2

Оксид углерода 2, также известный как угарный газ или диоксид углерода, является химическим соединением, состоящим из одной молекулы углерода и двух молекул кислорода. Это один из основных газов, выделяемых при сгорании углеводородов. Он также является продуктом дыхания и является причиной глобального потепления.
Некоторые металлы обладают способностью реагировать с оксидом углерода 2. Реакция этих металлов с CO2 может протекать как при нормальных условиях, так и при повышенной температуре и давлении.
Одним из металлов, обладающих способностью реагировать с оксидом углерода 2, является магний. При нагревании магния до определенной температуры происходит реакция с CO2, в результате которой образуется оксид магния (MgO) и выделяется углеродный газ (CO).
Еще одним металлом, способным реагировать с оксидом углерода 2, является железо. При нагревании железа с CO2 образуется оксид железа (FeO) и выделяется углеродный газ. Эта реакция может быть полезна для утилизации CO2 и уменьшения его концентрации в атмосфере.
Также, реакцию с оксидом углерода 2 можно провести с помощью других металлов, таких как цинк, алюминий и никель. При этом образуются соответствующие оксиды металлов и выделяется углеродный газ.
Использование металлов для восстановления оксида углерода 2 может быть полезным с точки зрения экологии и энергетики. Это позволяет не только утилизировать CO2, но и превращать его в полезные продукты, такие как оксиды металлов, которые могут использоваться в различных промышленных процессах.
Процесс восстановления оксида углерода 2
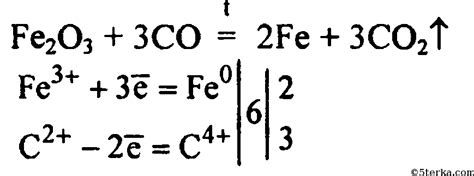
Восстановление оксида углерода 2 является химической реакцией, в результате которой молекулы газового CO2 превращаются в другие соединения. Для этого процесса требуется наличие определенных металлов, которые обладают способностью выступать в качестве катализаторов.
Одним из наиболее эффективных металлических катализаторов для восстановления CO2 является палладий. Палладий способен активировать молекулы оксида углерода 2 и участвовать в его восстановлении до более полезных соединений, таких как метан и формальдегид.
Также в качестве катализаторов для этого процесса могут выступать такие металлы, как железо, никель, рутений и медь. Однако палладий оказывается наиболее эффективным и активным катализатором при восстановлении оксида углерода 2.
Важно отметить, что процесс восстановления оксида углерода 2 является сложным и требует определенных условий, таких как наличие катализатора, определенной температуры и давления. Металлы, используемые в качестве катализаторов, обладают способностью принимать участие в реакциях и активировать молекулы CO2, чтобы образовать новые соединения.
Таким образом, процесс восстановления оксида углерода 2 является важным шагом в химических процессах, связанных с утилизацией CO2 и получением полезных соединений. Использование металлических катализаторов, в том числе палладия, позволяет сделать этот процесс более эффективным и экономически выгодным.
Вопрос-ответ

Какие металлы могут реагировать с оксидом углерода 2?
Оксид углерода 2 (CO2) является довольно стабильным соединением, поэтому не все металлы способны с ним реагировать. В то же время, некоторые металлы, такие как магний (Mg), алюминий (Al) и никель (Ni), имеют высокую активность и могут восстановить CO2 при нагревании до определенной температуры.
Как происходит реакция восстановления CO2 металлами?
Восстановление CO2 металлами происходит посредством отрыва кислорода от молекулы CO2 и образования новых соединений. Например, магний может прореагировать с CO2, образуя оксид магния (MgO) и освобождая углерод в виде чистого элемента или соединения (например, как углеродный наполнитель). Эта реакция является экзотермической и может протекать при достаточно высоких температурах в вакуумных или инертных условиях.
Для чего используется восстановление оксидом углерода 2 металлами?
Восстановление оксидом углерода 2 металлами имеет несколько потенциальных применений. Во-первых, это может быть использовано как способ утилизации CO2, который является одним из основных парниковых газов, и его восстановление в чистый углерод может снизить его концентрацию в атмосфере. Во-вторых, полученный при восстановлении углерод может быть использован в различных промышленных процессах, например, как катализатор или материал для производства электродов. Кроме того, эта реакция может быть полезной в различных научных исследованиях и технологических разработках.
