Восстановление иона металла в водном растворе – это процесс, при котором ион металла, находящийся в высоковалентном состоянии, превращается в ион со сниженной степенью окисления. Этот процесс является важной стадией в различных химических реакциях, включая электрохимические процессы, реакции растворения и некоторые биологические процессы.
Принципы восстановления иона металла в водном растворе основываются на взаимодействии с веществами, способными передать электроны, такими как ионы, молекулы или атомы. Восстановление может происходить посредством прямой передачи электрона от восстановителя к иону металла, а также через промежуточные реакции, включающие образование связей с другими атомами или молекулами.
Механизм восстановления иона металла в водном растворе может быть различным в зависимости от условий реакции и свойств восстановителя. Например, в некоторых случаях механизм восстановления может включать образование комплексов, в которых ион металла образует связи с другими атомами или молекулами. В других случаях механизм восстановления может быть связан со сменой ионного состояния металла или с изменением его координационной сферы.
Изучение принципов и механизмов восстановления иона металла в водном растворе имеет важное значение для понимания различных химических процессов и разработки новых методов синтеза и каталитических систем. Понимание этих принципов позволяет контролировать и улучшать эффективность восстановления металлов и применять их в различных областях, включая энергетику, экологию и медицину.
Восстановление иона металла в водном растворе:

Восстановление иона металла в водном растворе является процессом, при котором ион металла переходит из окисленного состояния в восстановленное. Этот процесс может происходить в присутствии различных веществ, таких как редуцирующие агенты или электрический ток.
Одним из основных механизмов восстановления иона металла в водном растворе является обмен электронами между ионами металла и редуцирующими агентами. В результате этого процесса ион металла получает дополнительные электроны и переходит в неполностью заряженное состояние.
Восстановление иона металла в водном растворе может также происходить при электрохимической реакции, когда на электрод наносится постоянное напряжение. В этом случае ион металла на электроде принимает электроны и восстанавливается.
Восстановление иона металла в водном растворе имеет широкое применение в различных областях, таких как химическая промышленность, электротехника и аналитическая химия. Этот процесс позволяет получить металлические соединения, которые могут быть использованы как катализаторы, электроды или активные компоненты в различных устройствах.
В целом, восстановление иона металла в водном растворе является важной химической реакцией, которая позволяет получить металлические соединения с желаемыми свойствами. Этот процесс основан на обмене электронами между ионами металла и редуцирующими агентами или применении электрического тока.
Принципы и механизмы восстановления иона металла в водном растворе

1. Реакция восстановления: Процесс восстановления иона металла в водном растворе основан на переходе металлического иона в более низкое окислительное состояние путем получения электрона или электронов от вещества, которое действует как восстановитель. Реакции восстановления могут быть электрохимическими или неэлектрохимическими.
2. Катодные процессы: Восстановление иона металла на катоде происходит благодаря поступлению электронов на катодную поверхность. Катодные процессы могут быть различных типов, включая электролиз, гальваническую коррозию и катодные реакции в химических реакциях.
3. Электролиз: В электролизе ион металла восстанавливается в состояние нулевой зарядности на катоде под воздействием приложенного электрического тока. Этот процесс основан на принципе электродных потенциалов и применяется для получения металлов из их солей.
4. Гальваническая коррозия: Гальваническая коррозия возникает при соединении металлического иона с другим металлом в электролите. В результате этого процесса один металл восстанавливается, а другой корродируется. Принцип гальванической коррозии используется в батареях, аккумуляторах и других электрохимических устройствах.
5. Химические реакции: Некоторые вещества могут служить восстановителями и вызывать химическую реакцию с ионом металла в водном растворе. В результате такой реакции ион металла может быть восстановлен, а вещество-восстановитель будет окислено. Химические реакции восстановления металлов широко применяются в производстве и химической промышленности.
Роль иона металла в водном растворе
Ион металла играет значительную роль в водных растворах и представляет собой активную частицу, способную взаимодействовать с другими реагентами и веществами. Металлические ионы могут выступать в роли катализаторов реакций, участвовать в окислительно-восстановительных процессах и регулировать рН среды.
Одной из важных функций иона металла в водном растворе является катализ реакций. Металлические ионы могут активировать определенные химические превращения, ускоряя их без участия самих ионов. Катализаторы на основе ионов металла используются в различных отраслях науки и промышленности, например, в производстве пластмасс или в катализе водородации органических соединений.
Ион металла также может выступать в роли окислителя или восстановителя. Окисление - это процесс передачи электронов от одного реагента к другому, при котором ион металла принимает электроны и тем самым восстанавливается. Восстановление, наоборот, происходит при передаче электронов от иона металла к другому реагенту, при этом металлический ион окисляется.
Кроме того, ионы металла влияют на рН среды в водном растворе. Некоторые металлические ионы могут образовывать кислоты или щелочи при растворении в воде. Это свойство может быть использовано для регулирования кислотно-щелочного баланса в химических реакциях или в процессах очистки воды, где требуется поддерживать определенный уровень рН.
Процессы окисления и восстановления

Процесс окисления – это реакция, при которой вещество теряет электроны и, следовательно, возрастает степень окисления. Окисление может происходить в результате взаимодействия с кислородом или другими окислителями. Окисление водорода в воде является частным случаем окисления.
Процесс восстановления – это реакция, при которой вещество приобретает электроны и, следовательно, уменьшается степень окисления. Восстановление может происходить за счет передачи электронов от других веществ или в результате взаимодействия с восстановителями.
Окислитель и восстановитель – это вещества, участвующие в окислительно-восстановительных реакциях. Окислитель получает электроны от вещества, которое окисляется, и при этом сам восстанавливается. Восстановитель, наоборот, отдает электроны веществу, которое восстанавливается, и при этом сам окисляется.
Окислительно-восстановительные реакции являются важным механизмом многих химических процессов. Они используются, например, в электрохимических элементах, где окислительно-восстановительные пары обеспечивают перенос электронов и тем самым генерацию электрического тока.
- Важно отметить, что окисление и восстановление могут происходить одновременно в рамках одной реакции.
- При окислительно-восстановительных реакциях может происходить изменение степени окисления атомов.
- Процессы окисления и восстановления могут быть катализированы различными веществами, такими как ферменты или ионы металлов.
Принципы восстановления иона металла

Восстановление иона металла в водном растворе является процессом, при котором металлические ионы превращаются из положительных в отрицательные. Этот процесс основывается на принципах, которые определяются свойствами металлических ионов и условиями реакции.
Одним из основных принципов восстановления иона металла является наличие в растворе вещества, способного участвовать в реакции редокс (окислительно-восстановительной реакции). Такое вещество называется восстановителем. Оно способно передавать электроны на ион металла, что приводит к его восстановлению.
Другим принципом восстановления иона металла является наличие ионов водорода (протонов) в растворе. Ионы металла могут принять электроны от восстановителя, но одновременно осуществить передачу протонов. Это происходит в случае, когда ион металла имеет большую аффинность к протонам, чем восстановитель. В результате ион металла восстанавливается, а восстановитель выступает в роли вещества, которое принимает протоны, образованные в результате реакции.
Восстановление иона металла также может осуществляться с участием электролитов, которые обладают высокой электрохимической активностью. Вещество с большими электрохимическими свойствами может замещать ион металла в реакции редокс и получить электроны от восстановителя.
Важным принципом восстановления иона металла является правильный выбор условий реакции, таких как температура, концентрация веществ, pH раствора и других параметров. Эти условия могут влиять на скорость и степень восстановления иона металла, а также на характер и направление реакции.
Механизмы восстановления иона металла

Восстановление иона металла в водном растворе является процессом, в результате которого ион металла получает электроны и превращается в нейтральный атом металла. Этот процесс может происходить различными механизмами, в зависимости от условий реакции и химических свойств металла.
Один из механизмов восстановления иона металла называется редокс-реакцией. В этом механизме электроны передаются от вещества, которое восстанавливает ион металла, к иону металла, который восстанавливается. Этот процесс сопровождается изменением валентности иона металла.
Другим механизмом восстановления иона металла является химическое восстановление. В этом случае, вместо передачи электронов, ион металла получает необходимые электроны от вещества, обладающего более высоким потенциалом окисления. После получения электронов, ион металла превращается в нейтральный атом металла.
Также, существует механизм восстановления иона металла с помощью света или тепла. В этом случае, энергия света или тепла передается на электроны ионов металла, вызывая их переход в возбужденное состояние. После этого, ион металла возвращается в основное состояние, при этом энергия передается обратно ионы металла, в результате чего они восстанавливаются.
Влияние условий на процесс восстановления
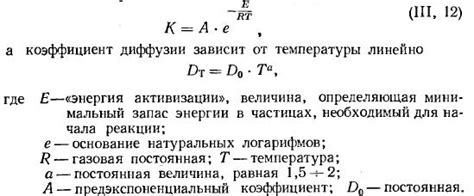
Процесс восстановления иона металла в водном растворе может зависеть от различных условий, таких как pH, температура, концентрация ионов металла, наличие катализаторов и т.д.
Один из ключевых факторов, оказывающих влияние на процесс восстановления, это pH раствора. При изменении pH может произойти изменение скорости реакции восстановления иона металла. Например, при низком pH (кислотных условиях) процесс восстановления может протекать быстрее, так как протонные ионы способны ускорять реакцию. В то же время, при высоком pH (щелочных условиях) процесс восстановления может замедляться из-за конкуренции реакции восстановления с другими реакциями, например, гидролизом ионов металла.
Температура также оказывает существенное влияние на процесс восстановления. При повышении температуры обычно происходит увеличение скорости реакции. Это связано с тем, что при повышении температуры молекулы становятся более активными и чаще сталкиваются, что способствует протеканию реакции восстановления более быстро. Однако, в некоторых случаях повышение температуры может также способствовать параллельным реакциям, которые могут снизить эффективность процесса восстановления.
Концентрация ионов металла в растворе также может влиять на процесс восстановления. Обычно, с повышением концентрации ионов металла увеличивается вероятность их столкновения с восстанавливающим агентом, что способствует ускорению процесса восстановления. Однако, при очень высокой концентрации ионов металла могут происходить конкурентные реакции, которые могут снизить эффективность восстановления.
Наличие катализаторов также может оказывать существенное влияние на процесс восстановления иона металла. Катализаторы могут ускорить реакцию, снизив энергию активации и увеличив скорость образования промежуточных комплексов. Это может привести к более эффективному и быстрому процессу восстановления иона металла.
Применение метода восстановления в различных отраслях
Метод восстановления иона металла в водном растворе находит широкое применение в различных отраслях промышленности и научных исследованиях.
Медицина: Возможность выборочного восстановления иона металла в водном растворе позволяет использовать этот метод в медицинских исследованиях. Это помогает в разработке новых препаратов, включая лекарственные препараты, стимулирующие регенерацию тканей и оказывающие положительное влияние на заживление ран и травм.
Электроэнергетика: Восстановление иона металла в водном растворе применяется в электроэнергетике для очистки ионов металлов из отходов производства. Это позволяет уменьшить загрязнение окружающей среды и повысить эффективность использования ресурсов.
Металлургия: Восстановление иона металла также применяется в металлургической промышленности для получения чистого металла из руды. Этот процесс позволяет улучшить качество металла и снизить затраты на производство.
Нанотехнологии: Метод восстановления иона металла в водном растворе находит широкое применение в нанотехнологиях. Он позволяет создавать наночастицы металлов с определенными свойствами, что открывает новые возможности в области разработки новых материалов и устройств.
Экология: Использование метода восстановления иона металла в водном растворе в экологических исследованиях позволяет определить загрязнение водных систем токсичными металлами и разработать меры по их очистке и сохранению экосистемы.
В целом, метод восстановления иона металла в водном растворе является мощным инструментом, который находит применение в широком спектре отраслей, помогая повысить качество продукции, снизить затраты и сделать процессы более экологически безопасными.
Вопрос-ответ

Какие принципы управляют процессом восстановления ионов металла в водном растворе?
Процесс восстановления ионов металла в водном растворе регулируется рядом принципов. Одним из них является принцип электрокинетической стабильности, который заключается в том, что в процессе восстановления ионов металла должно сохраняться равновесие между процессами окисления и восстановления. Также важны принципы энергетической стабильности, массовой стабильности и статистической стабильности.
Какие механизмы происходят при восстановлении ионов металла в водном растворе?
При восстановлении ионов металла в водном растворе происходят различные механизмы, в зависимости от условий процесса. Одним из механизмов является электронный перенос, при котором электроны передаются от восстанавливающего агента на ионы металла. Также может происходить протонный перенос, при котором протоны передаются между молекулами растворителя и ионами металла. Такие механизмы, как анионный перенос и реакция нуклеофильного замещения, также могут быть вовлечены в процесс восстановления ионов металла.
Какие факторы могут влиять на скорость процесса восстановления ионов металла в водном растворе?
Скорость процесса восстановления ионов металла в водном растворе может зависеть от различных факторов. Например, концентрация восстанавливающего агента может оказывать влияние на скорость реакции. Также температура реакционной среды может влиять на скорость процесса, поскольку увеличение температуры увеличивает скорость химических реакций. Однако, на скорость реакции может оказывать влияние и растворитель, используемый в процессе восстановления, а также наличие катализаторов или ингибиторов в системе.
