Азотная кислота (HNO3) является одним из наиболее распространенных и важных химических соединений. Она широко используется в химической промышленности, сельском хозяйстве и медицине.
Многие металлы обладают способностью восстанавливать кислородные соединения, включая азотную кислоту, до образования молекулярного водорода. Однако азотная кислота не восстанавливается металлами до водорода. Она остается в своей ионной форме, разлагаясь на ионы азота и атомы кислорода.
Это свойство азотной кислоты обусловлено ее высокой электроотрицательностью, которая делает ее ионизацию и разложение более предпочтительными процессами, чем восстановление до водорода. В результате реакции металлов с азотной кислотой образуются ионы металла и ионы азота.
Это свойство азотной кислоты имеет важные практические применения. Например, она может использоваться для окисления металлов и их соединений, а также для получения сложных органических соединений. Ее использование также позволяет получить высокие концентрации ионов азота, которые могут быть использованы в процессах синтеза и анализа.
Азотная кислота и ее восстановление
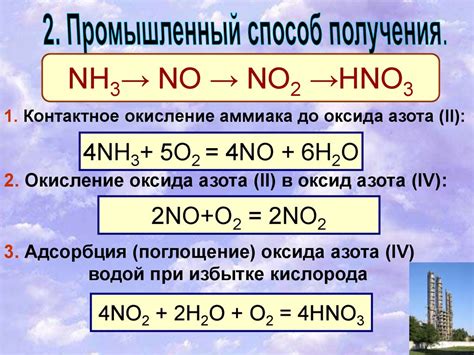
Азотная кислота, также известная как серная ортоазотная кислота или HNO3, является сильной минеральной кислотой. Эта химическое соединение широко используется в промышленности, в научных исследованиях и в процессах синтеза. Однако, азотная кислота имеет пониженную восстановительную активность.
Восстановление означает процесс превращения окислителя в соответствующее вещество с меньшим окислительным состоянием. Многие металлы, такие как железо или медь, способны восстанавливать кислород из азотной кислоты, образуя воду и оксид металла. Однако, азотная кислота не восстанавливается металлами до водорода, как это происходит с некоторыми другими кислотами, такими как соляная кислота.
Процесс восстановления азотной кислоты может быть произведен химический путем использования сильных восстановителей, таких как гидразин гидрат или серный anhydride. Оба эти метода позволяют преобразовать азотную кислоту в другие соединения с более низкими окислительными состояниями, например, в азотментиламин и диоксид азота соответственно. Однако, прямое восстановление азотной кислоты до водорода чрезвычайно трудно, требует высоких температур и каталитических систем.
Важно отметить, что ограниченная восстановительная активность азотной кислоты является одним из важных факторов, которые делают ее безопасной при хранении и транспортировке в промышленных масштабах. В то же время, эта особенность ограничивает применение азотной кислоты в некоторых химических реакциях, где требуется сильное восстановление.
Металлы и восстановление азотной кислоты

Азотная кислота (HNO3) является сильным окислителем и не может быть восстановлена до водорода при взаимодействии с металлами. Вода и азотистая кислота (HONO) являются конечными продуктами реакции металлов с азотной кислотой. Процесс восстановления азотной кислоты металлами называется «диспропорционированием».
Однако, некоторые металлы могут прореагировать с азотной кислотой, образуя нитраты металлов, которые могут быть использованы в различных промышленных процессах. Например, алюминий реагирует с азотной кислотой, образуя алюминиевый нитрат (Al(NO3)3).
Однако, такие реакции требуют специальных условий, таких как высокая концентрация азотной кислоты и присутствие катализаторов. Большинство металлов не способны восстановить азотную кислоту до водорода в обычных условиях.
Таким образом, восстановление азотной кислоты металлами до водорода не является характерным свойством металлов. Азотная кислота часто используется в различных химических процессах, но не может быть восстановлена до водорода металлами без дополнительных условий и катализаторов. Это важно учитывать при работе с азотной кислотой и металлами для избежания нежелательных реакций и неожиданных последствий.
Вопрос-ответ

Почему азотная кислота не восстанавливается металлами до водорода?
Азотная кислота (HNO3) обладает высокой окислительной активностью. Это означает, что она легко окисляет другие вещества. Когда металлы контактируют с азотной кислотой, например, при реакции диссоциации, азотная кислота окисляет металл до соответствующего катиона, а не до водорода. Это происходит потому, что окислительная сила азотной кислоты выше, чем окислительная сила водорода.
Какие реакции происходят при контакте металлов с азотной кислотой?
В случае контакта металлов с азотной кислотой, происходят различные реакции в зависимости от свойств металла и концентрации кислоты. Однако общая реакция может быть представлена следующим образом: металл + HNO3 → катион металла + азотная кислота + оксид азота. Таким образом, азотная кислота окисляет металл до соответствующего катиона, а не до водорода.
Почему не происходит выделение водорода при реакции металлов с азотной кислотой?
Выделение водорода при реакции металлов с азотной кислотой не происходит, потому что азотная кислота обладает высокой окислительной активностью. Она окисляет металл до соответствующего катиона вместо выделения водорода газом. Такая реакция может быть представлена следующим образом: металл + HNO3 → катион металла + азотная кислота + оксид азота.
Может ли азотная кислота восстанавливаться металлами до водорода в каких-то особых условиях?
В обычных условиях азотная кислота не восстанавливается металлами до водорода из-за своей высокой окислительной активности. Однако в определенных условиях, при наличии катализаторов или при повышенной температуре и давлении, металлы могут восстанавливать азотную кислоту до водорода. Это происходит благодаря сложным реакциям и не является типичным поведением азотной кислоты при взаимодействии с металлами.
