Металлы являются уникальными веществами благодаря своей восстановительной способности, которая позволяет им менять свою окислительную степень. Это свойство позволяет атомам металлов активно участвовать в реакциях окисления-восстановления, проявляя себя как мощные восстанавливающие агенты.
Восстановительная способность атомов металлов основана на их способности отдавать электроны. Металлы, будучи сильными донорами электронов, способны передавать их другим атомам или ионам, которые являются окислителями. Благодаря этому, металлы способны изменять свою окислительную способность и принимать на себя новые окислительные состояния.
Например, железо может иметь окислительное состояние Fe2+ и Fe3+. Восстанавливающие свойства железа позволяют ему принять электроны от окислителей и перейти из одного окислительного состояния в другое.
Восстановительная способность атомов металлов играет важную роль в множестве процессов в живых организмах и промышленных процессах. Они активно участвуют в процессах дыхания и фотосинтеза, а также являются основой для создания различных металлорганических соединений.
В заключение, восстановительная способность атомов металлов является их уникальным свойством, которое позволяет им активно участвовать в реакциях окисления-восстановления. Это свойство играет важную роль в различных процессах и имеет широкое применение в нашей повседневной жизни.
Восстановительная способность атомов металлов
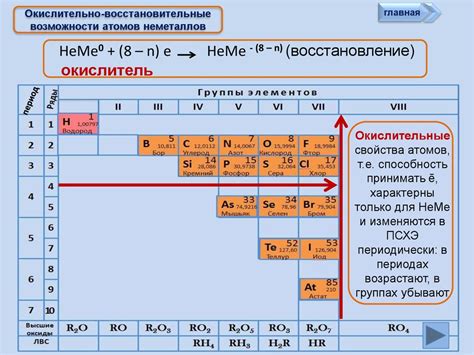
Восстановительная способность атомов металлов является одним из их уникальных свойств. Она определяет способность металлов претерпевать окислительно-восстановительные реакции, в результате которых металлы превращаются из ионов с положительным зарядом в нейтральные атомы.
Металлы могут вступать в непосредственные окислительно-восстановительные реакции с различными веществами, такими как кислород, водород, галогены и другие элементы. В результате таких реакций происходит передача электронов между атомами металла и других веществ, что позволяет восстанавливать металлические ионы до нейтральных атомов.
Восстановительная способность металлов может быть использована в различных областях, таких как промышленность, медицина и наука. Металлы, обладающие высокой восстановительной способностью, широко применяются в процессах электролиза, при производстве сплавов и многих других технологических процессах.
Восстановительная способность атомов металлов зависит от их электрохимических свойств, таких как электронная конфигурация и электроотрицательность. Многие металлы обладают высокой восстановительной способностью, что делает их важными компонентами в различных химических реакциях и процессах, включая реакции окисления и восстановления.
Уникальное свойство атомов металлов

Атомы металлов обладают уникальным свойством - восстановительной способностью. Это означает, что они способны передавать электроны другим веществам, изменяя свою окислительную способность.
Восстановительная способность атомов металлов играет важную роль в различных химических реакциях. Металлы часто выступают в качестве восстановителей, снижая окислительное состояние других веществ. Они способны отдавать электроны, чтобы уравновесить заряды и создать стабильную структуру соединения.
Это уникальное свойство атомов металлов приводит к широкому использованию металлов в различных отраслях, таких как производство батареек, катализаторов, электродов и многих других. Восстановительная способность металлов позволяет эффективно проводить электронные переносы и участвовать в электрохимических процессах.
Роль электронов в восстановительной способности
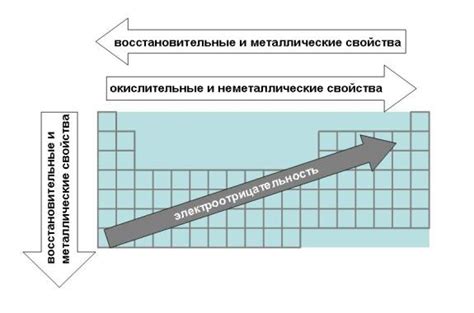
Большую роль в восстановительной способности атомов металлов играют их электроны. Внешние электроны атома металла, находящиеся на энергетически более высоких уровнях, обладают большей энергией и, следовательно, могут участвовать в химических реакциях восстановления.
Процесс восстановления осуществляется за счет перехода электронов с энергетически более высоких уровней на более низкие. При этом электроны передают свою энергию атомам, которые находятся в окружающей среде и нуждаются в восстановлении.
Электроны металлических атомов обладают свободной подвижностью и могут образовывать электронный газ, который является активным участником процессов восстановления. В процессе химических реакций металлические атомы могут отдавать или принимать электроны, как результат чего происходит изменение валентности атомов и образование соответствующих ионов.
Электроны также играют значительную роль при коррозии металлов. В процессе коррозии электроны переносятся с одного металла на другой, что вызывает окисление одного металла и восстановление другого. Таким образом, электроны обеспечивают катодно-анодные реакции, которые являются основой коррозионного процесса.
Потенциал восстановительной способности металлов

Металлы обладают уникальным свойством - восстановительной способностью. Это значит, что они могут принимать активное участие в химических реакциях, осуществлять окислительно-восстановительные процессы. Потенциал восстановительной способности металлов является одной из важнейших характеристик, которая определяет их химическую активность.
Потенциал восстановительной способности металлов определяется их электрохимическим потенциалом, то есть способностью отдавать или принимать электроны в химических реакциях. Чем выше электрохимический потенциал металла, тем больше вещества он способен восстановить.
Известно, что активные металлы как натрий, калий, магний имеют высокий потенциал восстановительной способности. Они способны легко отдавать электроны и входить в реакции с другими веществами. Например, натрий реагирует с водой, образуя щелочь и выделяя водород. Кроме того, они имеют способность к покрытию поверхности металла окисленным слоем, что защищает их от коррозии.
Наоборот, пассивные металлы, такие как золото, серебро, платина, имеют низкий потенциал восстановительной способности. Они слабо реагируют с другими веществами и обладают высокой устойчивостью к окислительным средам. Именно поэтому пассивные металлы широко используются в ювелирной и электронной промышленности.
Эффект восстановительной способности на химические реакции

Восстановительная способность атомов металлов - это их способность превращаться в положительно заряженные ионы, потеряв электроны в химической реакции. Этот эффект играет важную роль во многих химических процессах, таких как окислительно-восстановительные реакции и электрохимические реакции.
При окислительно-восстановительных реакциях восстановительные свойства атомов металлов проявляются в их способности передавать электроны другим веществам. Металлы, обладающие высокой восстановительной способностью, могут служить восстановителями в реакциях с окислителями. При этом они сами окисляются, теряют электроны и превращаются в положительно заряженные ионы.
Электрохимические реакции, основанные на восстановительной способности атомов металлов, находят широкое применение в различных областях, например, в батареях и аккумуляторах. Здесь металлический электрод, обладающий восстановительной способностью, служит источником электронов, которые передаются частицам в другом электроде, вызывая тем самым химические реакции, приводящие к выделению электрической энергии.
Восстановительная способность атомов металлов также используется в процессе гальванизации, где металлы наносятся на поверхность других материалов для защиты от коррозии или для придания им декоративного вида. Металлы, обладающие высокой восстановительной способностью, способны принимать электроны от окислителя и осаждаться на поверхность материала в виде металлического покрытия.
Влияние структуры кристаллической решетки на восстановительные свойства
Структура кристаллической решетки влияет на восстановительные свойства металлов, определяя их способность восстанавливать свою геометрическую форму после деформаций. Восстановительная способность атомов металлов является одним из их уникальных свойств.
Кристаллическая решетка металла состоит из множества атомов, упорядоченно расположенных в трехмерной сетке. Структура решетки определяется типом металла и его кристаллических структуры, таких как кубическая гранецентрированная (ГЦК), кубическая гранецентрированная (ГКЦ) или шестигранная решетка.
Восстановительные свойства металлов зависят от взаимодействия атомов в решетке при деформации. В кристаллической решетке атомы металла могут быть сжаты или растянуты, что влияет на их взаимное расположение и восстановительную способность. Наличие дефектов в решетке, таких как дислокации, также может влиять на восстановительные свойства металла.
Структура решетки металла не только влияет на его восстановительные свойства, но и на его механические и термические свойства. Изменение структуры решетки может быть вызвано различными факторами, такими как нагрузка, температура или воздействие других химических веществ. Понимание влияния структуры кристаллической решетки на восстановительные свойства металлов имеет большое значение для разработки новых материалов с улучшенными свойствами.
Механизм восстановления атомов металлов

Восстановительная способность атомов металлов является их уникальным свойством, которое обусловлено особым механизмом химических реакций. Когда атомы металла находятся в окружении атомов других элементов, они могут изменять свою степень окисления путем передачи или поглощения электронов.
Восстановление атомов металлов происходит путем снижения их степени окисления. Это означает, что атомы металла получают дополнительные электроны, что позволяет им вернуться к своему исходному состоянию с меньшей степенью окисления.
Одним из механизмов восстановления атомов металлов является окислительно-восстановительная реакция. В этом случае атомы металла передают свои электроны атомам других элементов, которые выступают в качестве окислителя. При этом атомы металла снижают свою степень окисления, а окислитель увеличивает свою.
Восстановительная способность атомов металлов имеет важное практическое значение. Она используется, например, в электрохимических процессах, таких как гальванические элементы и аккумуляторы. Также механизм восстановления атомов металлов является основой для процессов, связанных с очисткой воды и воздуха от загрязнений, а также для производства материалов с заданными свойствами.
Применение восстановительной способности металлов

Восстановительная способность металлов – это их уникальное свойство, которое находит широкое применение в различных отраслях промышленности и научных исследованиях. Она позволяет металлам восстанавливать свою молекулярную структуру и возвращать себе первоначальные свойства даже после значительных повреждений или деформаций.
Одним из основных областей применения восстановительной способности металлов является металлообработка. Благодаря этому свойству, металлы могут быть легко обработаны, сварены, паяны и прокатаны. Их молекулярная структура восстанавливается после воздействия высоких температур и механических нагрузок, позволяя получать из них сложные и прочные изделия.
Восстановительная способность металлов также находит применение в электротехнике и энергетической отрасли. Металлы используются в создании проводников электричества и материалов для аккумуляторов, так как они способны восстановить свою электропроводность после возникновения коррозии или других повреждений.
В медицине восстановительная способность металлов используется при создании имплантатов. Металлические протезы, вставленные в организм, способны заживать и интегрироваться с тканями, благодаря способности металлов к восстановлению своей структуры. Это позволяет пациентам быстро восстанавливаться и вести активный образ жизни.
Кроме того, восстановительная способность металлов используется в научных исследованиях, например, для создания новых материалов с различными свойствами. Изучение данного свойства металлов позволяет находить новые способы обработки материалов и разрабатывать инновационные технологии в различных отраслях промышленности.
Вопрос-ответ

Какое уникальное свойство имеют атомы металлов?
Уникальное свойство атомов металлов - их высокая восстановительная способность. Это означает, что атомы металлов могут легко переходить из одной химической формы в другую, принимая или отдавая электроны, и тем самым участвуя в химических реакциях.
Как восстановительная способность атомов металлов проявляется в химических реакциях?
Восстановительная способность атомов металлов проявляется в том, что они способны отдавать электроны другим веществам, таким образом восстанавливая их и сами окисляясь. Это свойство играет важную роль во многих процессах, например, в электролизе или в реакциях окисления-восстановления.
