Щелочные металлы — это элементы, расположенные в первой группе периодической таблицы, включающей литий, натрий, калий, рубидий, цезий и франций. Они характеризуются высокой химической реактивностью и способностью активно взаимодействовать с другими веществами. Интересной особенностью щелочных металлов является их восстановительная активность, способность снижать окислительное состояние других веществ.
Фактически, щелочные металлы являются сильными восстановителями, способными обменять свои электроны с другими веществами. Это связано с их электрохимическими свойствами, такими как низкая ионизационная энергия и высокая электропроводность. Восстановительная активность щелочных металлов проявляется в их способности образовывать ионы металла и переходить в более высокие окислительные состояния.
Такая восстановительная активность находит широкое применение в различных областях, включая химическую и фармацевтическую промышленность, электрохимию, металлургию и другие. Например, щелочные металлы используются в процессах электролиза, при синтезе органических соединений, в производстве сплавов и стали. Они также могут быть использованы в медицине для создания лекарственных препаратов и диагностических средств.
Щелочные металлы: свойства и использование
Щелочные металлы - это группа элементов периодической таблицы, включающая литий, натрий, калий, рубидий, цезий и франций. Они относятся к самым активным химическим элементам, имеют низкую плотность и низкую температуру плавления.
Основное свойство щелочных металлов — высокая реактивность. Они легко реагируют с водой, кислородом, халкогенами и другими неорганическими веществами. Более того, они имеют большую способность окисляться и выделять энергию, что делает их полезными в различных процессах и технологиях.
Одно из важных применений щелочных металлов - использование лития в производстве аккумуляторов. Литиевые ионные аккумуляторы широко применяются в электронике, мобильных телефонах, ноутбуках и электромобилях благодаря своей высокой энергетической плотности.
Натрий и калий находят применение в промышленности в процессах хлорирования, обезжиривания и очистки воды. Калий также используется в сельском хозяйстве в качестве удобрения. Рубидий используется в оптической и электронной промышленности, франций - в научных исследованиях и ядерной энергетике.
В целом, щелочные металлы являются важными элементами нашей жизни и применяются в различных сферах, от электроники до промышленности. Их свойства и использование позволяют нам вести эффективные процессы и создавать новые технологии, делая нашу жизнь легче и удобнее.
Реакция щелочных металлов с кислородом
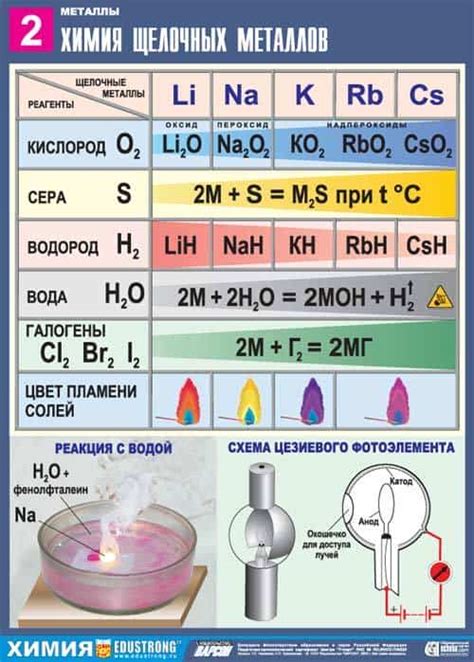
Реакция щелочных металлов с кислородом является одной из основных химических реакций, которые они могут выполнять. Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., обладают высокой активностью и легко реагируют с кислородом.
В результате реакции с кислородом, щелочные металлы образуют оксиды. Например, литий реагирует с кислородом и образует литиевый оксид (Li2O), натрий образует оксид натрия (Na2O), а калий образует оксид калия (K2O).
Реакция щелочных металлов с кислородом является экзотермической, то есть сопровождается выделением тепла. В процессе реакции, щелочные металлы окисляются, а кислород восстанавливается. Это означает, что щелочные металлы действуют в качестве восстановителей в данной реакции.
Реакция щелочных металлов с кислородом происходит при обычных условиях, без необходимости использования некоторых катализаторов или повышенных температур. В результате этой реакции образуются соединения, которые имеют свои особенности и могут быть использованы в различных областях, таких как промышленность, медицина и электроника.
Реакция щелочных металлов с водой

Щелочные металлы, такие как литий, натрий и калий, проявляют высокую восстановительную активность при контакте с водой. При взаимодействии с водой, щелочные металлы образуют гидроксиды и высвобождаются водородные газы.
Реакция начинается с того, что щелочный металл разрушает молекулу воды, освобождая водородный катион и гидроксидный анион. Гидроксидный анион затем образует гидроксид щелочного металла, а водородный катион выделяется в виде газа.
Процесс реакции щелочных металлов с водой происходит очень быстро и может сопровождаться высокой энергией. Во время реакции могут возникать пламя и пузырьки, образующиеся из высвобождающегося водорода.
Реакция щелочных металлов с водой является очень опасной и требует осторожности в обращении. Для избежания травм и возможных пожаров важно соблюдать правила безопасности при работе с этими веществами.
Химические свойства щелочных металлов

Щелочные металлы (литий, натрий, калий, рубидий, цезий, франций) обладают рядом характерных химических свойств, которые связаны с их электрохимическими особенностями.
Во-первых, щелочные металлы легко окисляются, образуя положительные ионы. Они являются самыми активными металлами в химической реактивности. Окисление щелочных металлов происходит уже при контакте с воздухом или водой.
Во-вторых, щелочные металлы образуют гидроксиды, которые обладают щелочной реакцией. Гидроксиды щелочных металлов, такие как гидроксид натрия (NaOH) и гидроксид калия (KOH), широко используются в промышленности и лабораториях в качестве щелочных веществ.
В-третьих, щелочные металлы реагируют с водой, образуя гидроксиды и выделяяся водород. Это реакция идет с выделением большого количества тепла и является одной из основных причин воспламенения щелочных металлов при контакте с водой.
Химические свойства щелочных металлов также проявляются в реакциях с кислотами, при которых образуются соли. Например, реакция натрия с соляной кислотой (HCl) приводит к образованию хлорида натрия (NaCl).
Кроме того, щелочные металлы обладают химической реактивностью и в реакциях с неорганическими и органическими веществами. Они способны образовывать соединения с различными элементами и группами функциональных групп, что делает их полезными в составе различных соединений в области промышленности, медицины и других отраслей.
Таким образом, химические свойства щелочных металлов подтверждают их высокую активность и восстановительную активность, которая является основной причиной их использования в различных сферах науки и технологии.
Возможность восстановительной активности щелочных металлов

Щелочные металлы, такие как литий, натрий, калий и др., обладают высокой степенью восстановительной активности. Это означает, что они способны восстановить окисленные вещества, приняв на себя электроны и тем самым проявив сильное окислительное действие.
Восстановительная активность щелочных металлов обусловлена их электрохимическими свойствами. Они обладают низкой ионизационной энергией, что позволяет им легко отдавать электроны. Кроме того, они имеют низкую электроотрицательность, что способствует активному вступлению в реакции.
Процесс восстановления щелочных металлов может протекать как в водных растворах, так и в других средах. В водных растворах, щелочные металлы образуют гидроксиды, такие как щелочные гидроксиды. Они широко используются в промышленности, медицине и других областях в качестве основных веществ.
Однако, стоит отметить, что восстановительная активность щелочных металлов может быть опасной при неправильном использовании. Их сильное окислительное действие может вызывать взрывоопасность и пожары. Поэтому, при работе с щелочными металлами необходимо соблюдать специальные меры предосторожности и правила безопасности.
Практическое применение щелочных металлов

Щелочные металлы (литий, натрий, калий и др.) имеют широкое практическое применение в различных отраслях народного хозяйства и научных исследований. Они используются, например, в производстве батарей, косметике, медицине, спортивных товарах и пищевой промышленности.
Одним из наиболее известных применений щелочных металлов является производство литий-ионных аккумуляторов, которые на сегодняшний день широко применяются в мобильных телефонах, ноутбуках, электрических автомобилях и других электронных устройствах. Литий обладает высокой энергоемкостью и способностью быстро заряжаться, что делает его идеальным материалом для создания мощных и компактных аккумуляторов.
Натрий и калий в щелочных металлах находят широкое применение в пищевой промышленности. Они являются неотъемлемой частью нашего питания, так как используются для приготовления и консервации пищевых продуктов. Натрий находится в составе кухонной соли, а калий используется в производстве удобрений и пищевых добавок. Кроме того, натрий применяется в производстве мыла и моющих средств, а также в процессе очистки воды.
Щелочные металлы также находят свое применение в медицине. Например, литий используется в лекарственных препаратах для лечения биполярного расстройства и депрессии. Калий является важным электролитом для нормального функционирования организма, а натрий участвует в регуляции водного баланса и функционировании нервной системы.
Таким образом, щелочные металлы имеют множество практических применений и являются неотъемлемой частью современных технологий и производственных процессов. Их уникальные свойства и возможности делают их востребованными в различных отраслях экономики и науки.
Вопрос-ответ

Действительно ли щелочные металлы обладают восстановительной активностью?
Да, щелочные металлы, такие как литий, натрий, калий и др., обладают высокой восстановительной активностью. Они способны вступать в реакцию с кислородом, диоксидом углерода и другими окислами, восстанавливая их в соответствующие основные соединения. Эта способность щелочных металлов называется редокс-активностью.
Какая роль щелочных металлов в природе?
Щелочные металлы играют важную роль в природе. Например, они составляют значительную часть земной коры и мантии. Кроме того, они являются неотъемлемыми компонентами многих минералов и горных пород. Щелочные металлы также имеют большое значение в пищевой и фармацевтической промышленности, а также в производстве электролитических и ионнообменных материалов.
