Металлы - это особый класс веществ, обладающих определенными химическими и физическими свойствами. Они широко применяются в различных отраслях промышленности и играют важную роль в повседневной жизни. Понимание химических свойств металлов является ключевым фактором для их использования и манипуляции с ними.
Одним из наиболее важных химических свойств металлов является их способность образовывать ионные соединения. Металлы, как правило, имеют низкую электроотрицательность и готовы отдать свои электроны, образуя положительно заряженные ионы. Именно благодаря этому свойству металлы образуют соли, оксиды и гидроксиды, которые часто используются в химической промышленности.
Еще одним важным химическим свойством металлов является их реакционная способность. Металлы активно взаимодействуют с другими веществами, образуя различные соединения и проявляя различные свойства. Некоторые металлы способны реагировать с кислородом воздуха и образовывать оксиды, что нередко приводит к образованию тугоплавких покрытий на их поверхности. Взаимодействие металлов с кислотами также приводит к образованию солей и выделению водорода.
Что такое химические свойства металлов?

Химические свойства металлов — это свойства, которые определяются способностью металлов давать химические реакции с другими веществами. Металлы обладают рядом уникальных химических свойств, которые делают их неотъемлемой частью нашей повседневной жизни.
Во-первых, металлы обладают способностью образовывать ионы положительного заряда. Это происходит за счет отдачи своих внешних электронов, что позволяет металлам образовывать положительно заряженные катионы. Именно благодаря этому свойству металлы могут реагировать с другими веществами и образовывать различные химические соединения.
Во-вторых, металлы обладают свойством быть хорошими проводниками электричества и тепла. Это связано с способностью их электронов свободно двигаться внутри металлической решетки. Этот факт объясняет почему металлы широко используются в электротехнике и теплотехнике.
Кроме того, металлы обладают высокой коррозионной стойкостью, что позволяет им сохранять свою форму и свойства при длительном взаимодействии с агрессивными средами. Благодаря этому свойству металлы широко используются в строительстве и производстве различных изделий.
В общем, химические свойства металлов делают их уникальными и необходимыми во многих сферах человеческой деятельности. Изучение и понимание этих свойств позволяет использовать металлы наиболее эффективно и разрабатывать новые технологии и материалы.
Какие химические свойства характерны для металлов?
1. Металлы обладают высокой тепло- и электропроводностью. Это свойство основано на наличии свободных электронов в металлической решетке. Благодаря этому металлы хорошо проводят тепло и электрический ток, что делает их незаменимыми материалами для производства проводников, электродов, кабелей и других электрических устройств.
2. Металлы являются реактивными элементами. Они имеют способность образовывать химические соединения со многими другими элементами. Например, металлы могут реагировать с кислородом и образовывать оксиды, с неэлектроположительными элементами и образовывать соли. Это свойство позволяет использовать металлы в различных отраслях промышленности, а также в химии и медицине.
3. Металлы обладают высокой пластичностью и прочностью. Они способны поддаваться пластической деформации без разрушения и имеют высокую прочность. Это свойство позволяет использовать металлы для создания различных конструкций, машин, автомобилей, а также для изготовления оружия и снарядов.
4. Металлы способны образовывать сплавы. Сплавы – это смеси двух или более металлов. Образование сплавов позволяет изменять химические и физические свойства металлов, делая их более приспособленными для конкретных условий эксплуатации. Например, железо можно сплавить с углеродом, получив сталь, которая обладает повышенной прочностью и твердостью.
5. Металлы могут образовывать ионы положительных зарядов. Когда атом металла теряет один или несколько электронов, он превращается в положительно заряженный ион. Это свойство объясняет способность металлов к электродной деятельности и их участие в различных электрохимических реакциях, например, в процессе электролиза или в качестве катодов в гальванических элементах.
Реакция металлов с кислотами: особенности и примеры
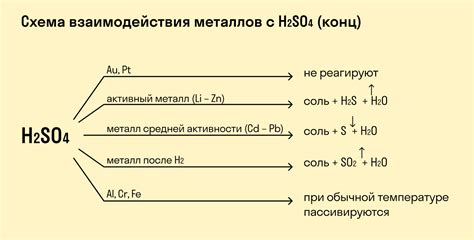
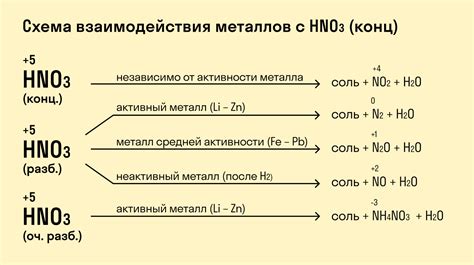
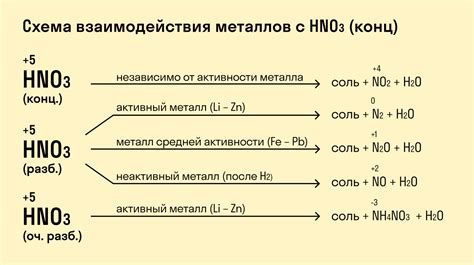
Металлы проявляют различную активность при взаимодействии с кислотами. Некоторые металлы реагируют с кислотами более активно, другие менее активно. Реакция металлов с кислотами связана с образованием солей и выделением водорода.
Самыми активными металлами являются щелочные и щелочноземельные металлы: натрий, калий, кальций и др. Они реагируют с кислотами с выделением водорода и образованием солей. Например, реакция натрия с соляной кислотой приводит к образованию соли - хлорида натрия и выделению водорода.
Некоторые металлы, такие как медь, серебро, золото, не реагируют с обычными кислотами, такими как соляная или уксусная кислота. Однако они могут реагировать с более сильными кислотами, например, с концентрированной азотной кислотой.
Также стоит отметить, что металлы могут реагировать не только с кислотами, но и с щелочами. Например, алюминий реагирует с щелочью натрия с образованием соли - гидроксида алюминия и выделением водорода.
Реакция металлов с кислотами является примером редокс-реакции, где металл окисляется, а водород из кислоты восстанавливается. Эта реакция является одним из основных методов получения солей в химии и имеет широкое практическое применение.
Взаимодействие металлов с щелочами и основаниями

Металлы активно взаимодействуют с щелочами и основаниями. Щелочи - это гидроксиды щелочных металлов (натрия, калия и др.), а основания - это соединения с высоким рН (например, кальций гидроксид). Взаимодействие металлов с щелочами и основаниями протекает по типу кислотно-основной реакции, при которой металл отдает электроны, образуется ион металла положительной заряды, а щелочь или основание принимает эти электроны.
В результате взаимодействия металлов с щелочами и основаниями образуется соль, а также молекулы воды. Соль образуется благодаря образованию ионов, например, Na+ или K+, и анионов, например, OH-. При этом металл активно реагирует с водой, выделяя водород в виде газа.
Взаимодействие металлов с щелочами и основаниями тесно связано с их химической активностью. Чем выше активность металла, тем интенсивнее протекает реакция с щелочами и основаниями. Например, щелочные металлы натрий и калий являются очень активными и реагируют с водой даже при небольшом контакте. В то же время, металлы средней активности, такие как магний или алюминий, требуют более силового воздействия для взаимодействия с щелочами и основаниями.
Окислительные свойства металлов: примеры и реакции
Окислительные свойства металлов – это способность металлов образовывать соединения с другими веществами, отдавая электроны и приобретая положительный заряд.
Реакции металлов с кислородом являются наиболее распространенным примером окислительных свойств. Многие металлы, такие как натрий (Na), калий (K), магний (Mg) и алюминий (Al), реагируют с кислородом воздуха, образуя оксиды. Например, натрий сгорает с яркой пламенной вспышкой, образуя белый оксид натрия (Na2O).
Другим примером окислительных свойств металлов является их реакция с кислотами. Цинк (Zn) реагирует с соляной кислотой (HCl), выделяя водород (H2) и образуя хлорид цинка (ZnCl2). Алюминий реагирует с серной кислотой (H2SO4) с образованием сульфата алюминия (Al2(SO4)3) и выделением диоксида серы (SO2) и водорода (H2).
С некоторыми кислотами металлы могут образовывать заряженные положительные ионы, которые являются окислителями. Например, соляная кислота (HCl) реагирует с медью (Cu), образуя купратный катион (Cu2+) и выделение газообразного хлора (Cl2).
Окислительные свойства металлов могут быть использованы в промышленности и в повседневной жизни. Например, некоторые металлы используются для очистки воды или в процессе производства электроэнергии. Знание этих свойств также помогает понять и предсказывать реакции, происходящие в химических системах.
Таблица ниже показывает некоторые примеры реакций металлов с кислородом и кислотами:
| Металл | Реакция с кислородом (оксиды) | Реакция с кислотами |
|---|---|---|
| Натрий (Na) | 2Na + O2 → 2Na2O | 2Na + 2HCl → 2NaCl + H2 |
| Магний (Mg) | 2Mg + O2 → 2MgO | Mg + 2HCl → MgCl2 + H2 |
| Цинк (Zn) | Zn + O2 → ZnO | Zn + 2HCl → ZnCl2 + H2 |
Коррозия металлов: причины и способы предотвращения

Коррозия металлов является процессом разрушения или повреждения металлической поверхности в результате химической реакции с окружающей средой. Основной причиной коррозии является окисление металла под воздействием кислорода и влаги.
Одним из способов предотвращения коррозии является использование покрытий на металлических поверхностях. Это могут быть различные защитные слои, такие как лаки, краски или антикоррозийные покрытия. Они создают барьер между окружающей средой и металлом, предотвращая его контакт с водой и кислородом.
Другим способом защиты от коррозии является использование анодной защиты. В этом случае на металлическую конструкцию прикладывается электрический потенциал, который делает ее анодом. Таким образом, металл постепенно представляет себя веществом с большей анодной активностью, что позволяет защитить его от окисления.
Также можно использовать катодную защиту, при которой создается электрический потенциал такого направления, чтобы металл стал катодом и не окислялся. Этот метод особенно эффективен для подводных металлических конструкций или устройств, которые находятся в контакте с водой.
Дополнительной мерой предотвращения коррозии является контроль окружающей среды. Влажность, содержание кислорода и химические примеси могут значительно влиять на скорость коррозии металлов. Поэтому важно поддерживать оптимальные условия окружающей среды и регулярно проводить мониторинг и контроль металлических конструкций.
- Использование покрытий на металлических поверхностях.
- Анодная защита.
- Катодная защита.
- Контроль окружающей среды.
Формирование сплавов: значимость и особенности

Формирование сплавов является важным процессом в металлургии и имеет широкое применение в различных отраслях промышленности. Сплавы обладают уникальными свойствами, которые недоступны для отдельных металлов и позволяют создавать материалы с оптимальными характеристиками для конкретных задач.
Основное преимущество сплавов заключается в том, что они объединяют лучшие свойства разных металлов. Путем сочетания нескольких металлических элементов можно достичь улучшения прочности, твердости, устойчивости к коррозии и других свойств материала. Также сплавы могут иметь специальные свойства, такие как память формы или способность сопротивлять высоким температурам.
Процесс формирования сплавов осуществляется путем плавления основного металла и добавления специальных примесей, называемых сплавляющими элементами. Список возможных сплавляющих элементов очень велик и может включать такие металлы, как никель, медь, цинк, алюминий и другие.
Выбор соотношения исходных металлических компонентов, температуры плавления и других параметров позволяет контролировать свойства готового сплава. Например, добавление небольшого количества сплавляющего элемента может значительно повысить прочность материала. Однако, необходимо учесть, что изменение состава сплава может также привести к потере других полезных свойств или ухудшению обрабатываемости материала.
Как металлы влияют на окружающую среду: экологические аспекты

Металлы являются неотъемлемой частью нашего современного образа жизни, однако их добыча, производство и использование оказывают значительное влияние на окружающую среду. Один из основных экологических аспектов связан с загрязнением водных ресурсов. В процессе добычи и обработки металлов, могут выделяться опасные химические соединения, которые попадают в воду и загрязняют ее. Это может повлечь за собой проблемы для водных экосистем и угрозу для здоровья людей, питающихся рыбой из загрязненных водоемов.
Еще одним важным экологическим аспектом является выброс вредных веществ в атмосферу. Металлы и их соединения могут быть выброшены в результате сжигания отходов, процессов нагрева и плавки металлов. Вредные выбросы образуют аэрозольные частицы, которые затем могут оседать на поверхности почвы и растениях. Это может негативно повлиять на качество воздуха и здоровье людей, а также способствовать появлению кислотных дождей.
Кроме того, металлы могут оказывать токсическое воздействие на живые организмы. Некоторые металлы, как например свинец или меркурий, являются ядовитыми и могут накапливаться в организмах животных и человека. Это может привести к различным заболеваниям и нарушениям функций органов.
В целом, экологические аспекты влияния металлов на окружающую среду являются важным аспектом, который нужно учитывать при разработке и реализации промышленных и экономических проектов. Необходимо стремиться к более эффективной и безопасной эксплуатации металлических ресурсов, а также развивать и применять новые технологии, которые позволят снизить негативное воздействие на окружающую среду.
Вопрос-ответ

Какие химические свойства металлов?
Металлы имеют ряд характерных химических свойств, таких как высокая электропроводность, теплопроводность, способность к формированию ионов положительного заряда (катионов) и образованию ионных связей. Они также обладают способностью образовывать сплавы и растворы с другими металлами.
Какая основная химическая реакция, которую металлы проходят?
Одной из основных химических реакций, которую металлы проходят, является реакция окисления. При окислении металла он образует положительно заряженные ионы, которые взаимодействуют с отрицательно заряженными ионами поблизости. Это может привести к образованию оксидов или солей. Например, железо при окислении может образовывать ржавчину.
