Металлы имеют широкое применение в нашей жизни и нашей технологической среде. Однако, есть определенные металлы, которые невозможно получить с использованием электролиза водных растворов их солей. Это связано с различными физико-химическими свойствами этих металлов.
Одним из таких металлов является золото. Золото – драгоценный металл, который используется в ювелирном и электронном производстве. Однако, получить золото электролизом водного раствора его соли невозможно из-за его высокой стандартного окислительно-восстановительного потенциала. В результате, золото добывают из его руды другими способами.
Ещё одним металлом, который невозможно получить электролизом водных растворов его солей, является платина. Платина – редкий и ценный металл, который широко используется в химической, электронной и медицинской промышленности. Однако, из-за высокой электрохимической устойчивости платины, электролиз таких растворов становится невозможным.
Ещё одним примером металла, недоступного для получения электролизом водных растворов его солей, является серебро. Серебро – драгоценный металл, который используется в ювелирной и электронной промышленности, а также в фотографии. Но из-за его высокого стандартного окислительно-восстановительного потенциала, электролиз водного раствора соли серебра не является эффективным способом получения этого металла.
Металлы, недоступные для электролиза

При электролизе водных растворов солей многих металлов можно получить их чистую форму. Однако существуют металлы, которые недоступны для получения таким способом. Это связано с их высокой химической активностью и способностью образовывать стабильные соединения, которые не могут быть разложены электролизом.
Один из таких металлов - алюминий. Алюминий образует стабильный оксид - алюминийоксид (Аl2O3), который покрывает поверхность алюминия и препятствует его разложению под действием электролиза. Поэтому алюминий получают методом электролиза расплавленной алюминийоксидной смеси, так называемым процессом Холл-Эроу.
Еще один металл, который невозможно получить электролизом водных растворов его солей - это железо. Железо образует стабильный оксид - железооксид (Fe2O3), который не разлагается под действием электролиза. Поэтому получение чистого железа также производится по другим способам, включая прямое восстановление железорудного материала.
Следующий металл, недоступный для получения электролизом, - медь. Медь образует стабильные соединения с кислородом и серой, которые не разлагаются под действием электролиза. Поэтому медь получают путем плавления медиистых сульфидных и оксидных руд.
Таким образом, не все металлы доступны для получения электролизом водных растворов их солей. Некоторые металлы образуют стабильные соединения, которые не могут быть разложены под действием электролиза, и требуют использования других методов получения.
Определение электролиза
Электролиз - это процесс разложения химических соединений под влиянием электрического тока. В основе электролиза лежит перенос заряда через электролит, что приводит к окислению одного вещества на аноде и восстановлению другого на катоде.
Для проведения электролиза необходимо наличие электролита, который может быть как жидким, так и растворенным веществом. Также требуется наличие электродов - положительного анода и отрицательного катода, через которые протекает электрический ток.
Электролиз может протекать в виде постоянного или переменного тока. Важно отметить, что электролиз может происходить только в тех случаях, когда напряжение электрического источника достаточно высокое для преодоления энергетических барьеров веществ, составляющих электролит.
В результате электролиза происходит образование новых химических соединений на электродах. Обычно на аноде происходит окисление, а на катоде - восстановление. Электролиз широко применяется в процессах производства различных веществ, включая металлы и сплавы, а также для получения различных продуктов в химической промышленности.
Металлы, доступные для электролиза

Электролиз - это процесс разложения вещества под воздействием электрического тока. Металлы, доступные для электролиза, включают в себя множество элементов, таких как: железо, медь, цинк, никель, алюминий и другие. Используя электролиз, можно получить эти металлы в чистом виде из их растворов или расплавов.
Один из важных параметров, определяющих возможность электролиза, - это потенциал окислительно-восстановительного потенциала металла. Чем более положительное значение потенциала, тем более легко происходит окисление металла и его электролитическое осаждение.
Электролиз медных растворов позволяет получить чистую медь, которую можно использовать в различных областях, включая производство проводов, электронику и строительство. Железо также доступно для электролиза, что позволяет получать чистое железо, применяемое в металлургической и строительной промышленности.
Цинк, никель и алюминий также могут быть получены методом электролиза. Цинк применяется в производстве защитных покрытий, никель используется в гальванике и электронике, алюминий - один из самых распространенных металлов, который находит применение в авиации, строительстве, производстве упаковочных материалов и других отраслях промышленности.
Таким образом, электролиз - важный метод получения множества металлов, доступных для использования в различных отраслях промышленности. Этот процесс позволяет получать чистые металлы из их соединений и является важной технологией, способствующей развитию современного производства.
Процесс электролиза солей металлов
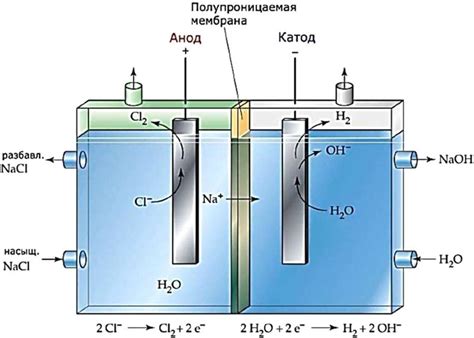
Процесс электролиза солей металлов является одним из способов получения чистых металлов. Он основан на использовании электрического тока для разложения солей металлов на положительные и отрицательные ионы. Это позволяет извлечь металл из соли и использовать его в различных промышленных процессах.
Для проведения электролиза необходимо использовать специальные устройства, называемые электролизерами. В электролизере размещаются два электрода: катод и анод. Катод – это отрицательный электрод, на который будут осаждаться положительные ионы металла. Анод – это положительный электрод, на котором происходит процесс окисления отрицательных ионов.
Процесс электролиза осуществляется в растворе соли металла или плавящейся соли. Раствор или плавящаяся соль служат электролитом, обеспечивающим проводимость электрического тока. Во время проведения электролиза происходит движение ионов к электродам, где они подвергаются окислению или восстановлению.
Однако не все металлы могут быть получены электролизом их солей. Некоторые металлы, такие как золото и платина, имеют высокую степень стабильности и не подвергаются разложению водным раствором своих солей. Поэтому для получения этих металлов применяются другие методы, такие как пирометаллургические процессы или химические реакции.
Выводя позитивные ионы металла на катод, процесс электролиза позволяет получить металл в чистом виде с высокой степенью очистки. Благодаря этому, электролиз солей металлов широко применяется в различных отраслях промышленности, включая обработку металлов, производство проводников, аккумуляторов и др. Также электролиз используется в лабораторных исследованиях для получения металлических образцов для анализа и дальнейших исследований.
Металлы, недоступные для электролиза водных растворов их солей
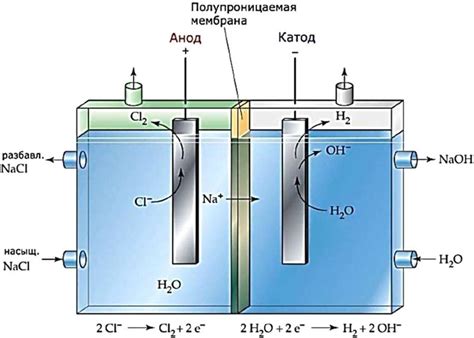
Электролиз водных растворов металлических солей является одним из способов получения металлов. Однако не все металлы могут быть получены данным методом, так как они не обладают достаточной реактивностью или их соединения не диссоциируются в водных растворах. Это может быть связано с их высокой электроотрицательностью или стабильностью оксидов.
Одним из таких металлов является золото. Золото обладает низкой электроотрицательностью и стабильностью, поэтому его соединения практически не диссоциируются в воде. Из-за этого электролиз водного раствора золотых солей не является эффективным способом получения золота.
Еще одним металлом, недоступным для электролиза водных растворов его солей, является платина. Платина химически стабильна и практически не реагирует с водой, что делает ее соединения малорастворимыми. Поэтому электролиз платиновых солей также не является эффективным способом получения платины.
Также недоступны для электролиза водных растворов их солей металлы, такие как серебро и родий. Серебро обладает высокой электроотрицательностью и стабильностью, а родий имеет высокую степень инертности. Их соединения практически не реагируют с водой и поэтому электролиз их солей не приводит к получению соответствующих металлов.
В заключение, электролиз водных растворов металлических солей является эффективным методом получения многих металлов. Однако для некоторых металлов данный метод не применим из-за низкой реактивности, высокой стабильности соединений или недостаточного разложения солей в воде.
Причины недоступности электролиза
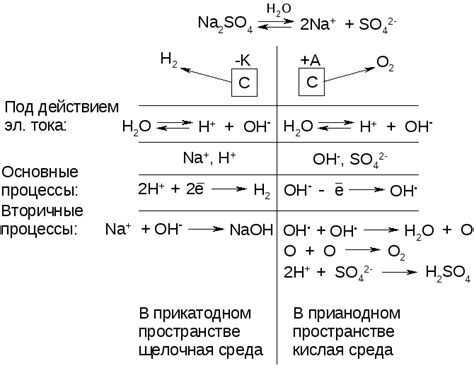
Водные растворы некоторых металлов не могут быть электролизованы в силу различных факторов, которые препятствуют процессу электролиза. Важными причинами недоступности электролиза являются:
- Высокое потенциальное напряжение: Некоторые металлы обладают высокими значениями потенциального напряжения, что делает электролиз водных растворов их солей технически неосуществимым. К таким металлам относятся например, золото, платина и родий.
- Низкая концентрация ионов: Для успешного электролиза необходима достаточно высокая концентрация ионов металла. Если концентрация ионов слишком низкая, то процесс электролиза будет медленным и неэффективным. Данный фактор является главной причиной недоступности электролиза некоторых редких металлов, таких как иридий и рутений.
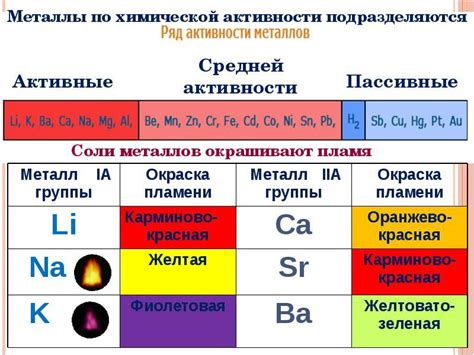
- Неустойчивые реакции: Некоторые металлы в водных растворах их солей образуют неустойчивые соединения, которые легко распадаются и не могут быть электролизированы. Например, металлы группы 1 периодической системы (натрий, калий, литий) образуют гидроксиды, которые растворяются в воде и не могут быть электролизированы в чистом виде.
- Высокая температура плавления: Некоторые металлы имеют очень высокую температуру плавления, что делает процесс электролиза неэффективным или даже невозможным. Это особенно характерно для тугоплавких металлов как, например, вольфрам и молибден.
- Химическая стабильность: Некоторые металлы обладают высокой химической стабильностью и не могут быть электролизированы в водных растворах. Например, платина и золото являются очень химически инертными металлами и не подвержены электролизу в обычных условиях.
Альтернативные методы получения

В некоторых случаях металлы, недоступные для получения электролизом водных растворов их солей, могут быть получены другими способами. Одним из таких способов является метод восстановления металлов. В этом случае металлические ионы превращаются в металлы, используя для этого химическую реакцию с веществом-восстановителем.
Другим альтернативным методом получения недоступных металлов является метод высокотемпературного восстановления. При этом металлы извлекают из их окислов или минеральных руд путем нагревания до очень высоких температур. Затем полученный металл можно подвергнуть дополнительной обработке для получения чистого продукта.
Также существует метод электротермического производства металлов, который основан на использовании электрической энергии для передачи энергии между потребителем и системой, содержащей металлические ионы. При таком методе металлические ионы восстанавливаются до металла с помощью электрического тока, что позволяет получить металлы, недоступные для электролиза водных растворов их солей.
Применение металлов, недоступных для электролиза
В настоящее время существует множество металлов, которые невозможно получить с помощью электролиза водных растворов их солей. Однако, это не означает, что эти металлы не имеют никакого применения. Напротив, они находят свое применение в различных отраслях промышленности и научных исследованиях.
Одним из примеров металлов, недоступных для электролиза, является платина. Платина обладает высокой коррозионной стойкостью, низким коэффициентом теплового расширения и многочисленными каталитическими свойствами. Благодаря этим характеристикам, платина широко применяется в производстве ювелирных изделий, электродов для электролиза веществ, каталитических систем и других высокотехнологичных отраслях.
Еще одним недоступным для электролиза металлом является родий. Родий обладает высокой стойкостью к различным воздействиям, таким как окисление, коррозия и агрессивные составы. Благодаря этим свойствам, родий применяется в производстве катализаторов, оптических систем, электронных компонентов, а также в ювелирной промышленности.
Особняком стоит золото, которое также недоступно для получения через электролиз водных растворов его солей. Золото издавна используется в ювелирной промышленности в виде драгоценного металла и находит применение в производстве различных украшений и изделий ручной работы. Однако, его свойства также находят применение в медицине, электронике, косметологии и других отраслях.
Таким образом, металлы, недоступные для электролиза, играют важную роль в различных сферах промышленности и научных исследованиях. Их химические и физические свойства делают их незаменимыми материалами для разработки новых технологий и создания высокотехнологичных изделий.
Вопрос-ответ

Можно ли получить все металлы электролизом водных растворов их солей?
Нет, не все металлы доступны для получения электролизом водных растворов их солей. Некоторые металлы слишком реактивны и немедленно реагируют с водой, а другие металлы имеют такую высокую степень окисления, что их соли невозможно редуцировать электролизом.
Какие металлы невозможно получить электролизом водных растворов их солей?
Некоторые металлы невозможно получить электролизом водных растворов их солей из-за их высокой степени окисления. К таким металлам относятся, например, золото, платина и серебро. Эти металлы имеют настолько высокие потенциалы окисления, что они не могут быть редуцированы водой, поэтому их производство требует других методов.
Почему некоторые металлы недоступны для получения электролизом водных растворов их солей?
Некоторые металлы недоступны для получения электролизом водных растворов их солей из-за их высокой реактивности или высокой степени окисления. Например, металлы, такие как натрий и калий, очень реактивны и немедленно реагируют с водой, образуя щелочи. А золото, платина и серебро имеют настолько высокие потенциалы окисления, что их соли невозможно редуцировать водой.
