Водородное разложение металлов при реакции с азотной кислотой является одной из важных реакций, которая применяется в химической промышленности и лабораторных исследованиях. В результате этой реакции образуется водородный газ и соответствующий солевой комплекс металла, который осаждают в виде нерастворимых осадков или можно получить в растворе.
Реакция между металлами и азотной кислотой основана на окислительно-восстановительной химической реакции. Металл участвует в реакции как восстановитель, переходя из ионной формы в нейтральное состояние. Водород, в свою очередь, выполняет роль окислителя, принимая электроны от металла и образуя нерастворимые гидроксиды, оксиды или азиды металла.
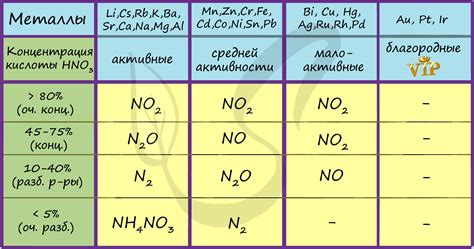
Важно отметить, что реакция водородного разложения металлов с азотной кислотой может протекать с различной интенсивностью в зависимости от свойств и химической активности металла. Некоторые металлы, такие как магний или цинк, реагируют со средней или высокой интенсивностью, образуя значительное количество водорода. Другие металлы, например, золото или платина, обладают незначительной активностью в реакции с азотной кислотой и образуют незначительное количество водорода.
Влияние азотной кислоты на металлы
Азотная кислота является сильным окислителем и обладает высокими окислительными свойствами. При реакции с металлами она проявляет активность, вызывая их разложение.
Влияние азотной кислоты на металлы зависит от их активности и реакционной способности. Некоторые металлы, такие как железо, алюминий и магний, растворяются в азотной кислоте с образованием соответствующих солей и выделением водорода.
Азотная кислота проникает в металлическую структуру и взаимодействует с его металлическими ионами, вызывая окисление металла до ионного состояния. Это приводит к образованию солей и отделению молекулярного водорода.
Некоторые металлы, такие как золото и платина, обладают низкой реакционной способностью и практически не взаимодействуют с азотной кислотой. Однако более активные металлы, такие как натрий и калий, реагируют с азотной кислотой с высокой интенсивностью.
Реакция металлов с азотной кислотой широко используется в химической промышленности для получения соответствующих солей и промежуточных продуктов. Это важный процесс, который находит применение в производстве различных химических соединений и материалов.
В заключение, азотная кислота оказывает существенное влияние на металлы, вызывая их разложение и образование соответствующих солей. При взаимодействии с металлами она проявляет свои окислительные свойства, что делает ее важным реагентом в химической промышленности.
Процесс водородного разложения
Водородное разложение металлов при реакции с азотной кислотой является одним из важных процессов, используемых в химической промышленности и лабораторной практике. Данный процесс основан на способности металлов образовывать ионные соединения с азотной кислотой и, параллельно, выделяться молекулярный водород.
Водородное разложение металлов происходит в несколько стадий. Сначала металлический металл вступает в реакцию с азотной кислотой, образуя соответствующее ионное соединение и молекулярный водород. Затем в процессе реакции образовавшийся водород выделяется в виде пузырьков. При этом водород может проходить через раствор и подниматься вверх или оседать на поверхности металла.
Процесс водородного разложения металлов во время реакции с азотной кислотой может быть использован не только для получения молекулярного водорода, но и для определения концентрации металла в пробе. При этом количество выделенного водорода пропорционально количеству металла в пробе и может быть измерено с помощью специального аппарата - водородного метроносителя. По полученным данным можно определить концентрацию металла в пробе и произвести необходимые расчеты.
Следует отметить, что процесс водородного разложения металлов с азотной кислотой может быть опасен и требует соблюдения безопасных условий. В процессе реакции выделяется молекулярный водород, который является горючим и взрывоопасным газом. Поэтому необходимо соблюдать меры предосторожности при работе с азотной кислотой и металлами, обеспечивать хорошую вентиляцию помещения и использовать соответствующую защитную экипировку.
Химические свойства азотной кислоты
Азотная кислота - одна из наиболее распространенных и важных неорганических кислот. Она обладает несколькими характеристическими химическими свойствами, которые делают ее важным реагентом в различных химических процессах и промышленных производствах.
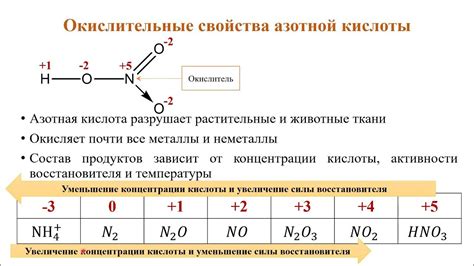
Во-первых, азотная кислота обладает сильными окислительными свойствами. Она способна окислять многие органические и неорганические вещества, включая металлы, газы и органические соединения. При этом она сама восстанавливается, превращаясь в более высокоокисленные соединения.
Во-вторых, азотная кислота является сильным протонным донором, что делает ее кислотной веществом. Она образует стабильные соли, называемые нитратами, которые широко используются в качестве удобрений, взрывчатых веществ и других промышленных продуктов.
Кроме того, азотная кислота обладает высокой растворимостью в воде, что облегчает ее использование в химических реакциях. Она может быть использована для промывки и обезжиривания поверхностей, а также для очистки и обработки металлов.
Наконец, азотная кислота является основным источником азота в природе. Азотные соединения, такие как аммиак и нитраты, играют ключевую роль в обмене азота между живыми организмами и окружающей средой. Они являются необходимыми элементами для роста и развития растений, а также для образования белков и ДНК в живых организмах.
Вопрос-ответ

Почему при реакции с азотной кислотой металлы разлагаются с выделением водорода?
При взаимодействии металлов с азотной кислотой происходит окислительно-восстановительная реакция, в которой металл окисляется азотной кислотой, азотная кислота же восстанавливается. С одновременным разложением воды получается водород и ионы металла, которые растворяются в растворе азотной кислоты.
Какие металлы могут разлагаться при реакции с азотной кислотой?
При реакции с азотной кислотой разлагаются активные металлы, такие как цинк (Zn), железо (Fe) или алюминий (Al). Это связано с их способностью быть окисленными азотной кислотой. Более пассивные металлы, такие как серебро (Ag) или золото (Au), не разлагаются при этой реакции.
