Щелочные металлы и щелочноземельные элементы – две группы химических элементов, расположенных в периодической системе Менделеева. И хотя они имеют схожие названия, эти две группы различаются как по строению атомов, так и по своим химическим свойствам. Одной из ключевых различий является наличие или отсутствие внешней электронной оболочки, отвечающей за характерные для каждой группы свойства.
Щелочные металлы – это первая группа расположенных слева от центральной разделительной линии элементов периодической системы. Эта группа включает элементы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают характрными химическими свойствами, такими как низкая плотность, высокая химическая активность, способность реагировать со многими другими элементами, образуя ионные соединения с положительными зарядами.
В отличие от щелочных металлов, щелочноземельные элементы – это вторая группа, следующая за щелочными металлами в периодической системе. Группа включает элементы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Щелочноземельные элементы также обладают некоторыми общими характеристиками, такими как химическая активност и способность образовывать ионные соединения.
Интересно, что оба класса элементов – щелочные металлы и щелочноземельные – могут реагировать с водородом, но при этом с разными результатами. Так, щелочные металлы могут образовывать гидриды, которые обладают высокой степенью химической активности, тогда как щелочноземельные элементы утрачивают подобную способность и не образуют гидриды с водородом. Вода является исключением – она разрешает себе взаимодействовать и с щелочными металлами, и с щелочноземельными элементами, образуя соединения известные как оксиды металлов.
Химические элементы и их классификация
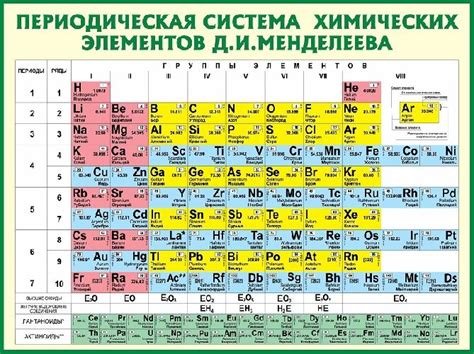
Химические элементы являются основными строительными блоками всей материи. Они состоят из атомов с определенным числом протонов в их ядре. В таблице Менделеева элементы классифицированы по их атомному номеру, который соответствует числу протонов в ядре атома.
Существует много способов классификации химических элементов. Наиболее распространенные классификации основаны на химических свойствах элементов, их электронной конфигурации или их группировке по определенным химическим свойствам.
Одна из основных классификаций элементов основана на их металлических свойствах. Относительно металлического характера элементы могут быть разделены на металлы, полуметаллы и неметаллы. Металлы характеризуются твердым состоянием при комнатной температуре и блестящей поверхностью, полуметаллы обладают свойствами как металлов, так и неметаллов, а неметаллы обычно являются хрупкими и не проводят электричество или тепло.
Другой способ классификации основан на электронной конфигурации элементов. Элементы могут быть разделены на блоки s, p, d и f в зависимости от последнего заполненного энергетического уровня электронов. Каждый блок имеет свои уникальные химические свойства.
Щелочные металлы: свойства и применение

Щелочные металлы - это группа элементов периодической таблицы, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой химической активностью и мягкостью, что позволяет им образовывать легкие сплавы с другими металлами.
Одно из главных свойств щелочных металлов - их способность активно реагировать с кислородом и водой. Они возгораются при контакте с воздухом и образуют щелочные оксиды, а со взаимодействием с водой выделяется водород. Это делает их опасными для хранения и требует особых условий манипуляции.
Кроме того, эти металлы хорошие проводники электричества и тепла. Они широко используются в электротехнике, производстве щелочных аккумуляторов, катодах ламп, сплавов для высоких температур, силицидах и галогенидах.
Щелочные металлы также играют важную роль в биологии, поскольку являются необходимыми элементами для функционирования организмов. Они участвуют в обмене веществ, регулируют кислотно-щелочной баланс и нервную деятельность. Без них невозможна жизнедеятельность организмов.
Каждый из щелочных металлов имеет свои особенности и применение. Например, литий широко используется в производстве легких сплавов и аккумуляторов, натрий - в стекольной промышленности, калий - в сельском хозяйстве как удобрение. Рубидий и цезий применяются в научных исследованиях, а франций, самый редкий и радиоактивный из них, имеет ограниченное применение в научно-исследовательских целях.
Щелочноземельные металлы: особенности и использование

Щелочноземельные металлы - это группа элементов периодической системы, включающая бериллий, магний, кальций, стронций, барий и радий. Они расположены под щелочными металлами и характеризуются своими удивительными свойствами.
Первой характерной особенностью щелочноземельных металлов является их высокая реактивность. Они активно взаимодействуют с водой, кислородом и другими веществами. Это связано с наличием двух электронов в валентной оболочке, которые легко отдаются и образуют положительные ионы.
Щелочноземельные металлы имеют низкую плотность и температуру плавления, что делает их легкими и простыми в использовании. Они обладают высокой электропроводностью и применяются в производстве электроники и электротехники.
Эти металлы также широко использовались в прошлом в процессе производства сплавов и легирования других материалов. Например, бериллий используется для создания легких и прочных сплавов, а магний - в авиационной и автомобильной промышленности.
Однако на сегодняшний день использование щелочноземельных металлов ограничено из-за их токсичности и высокой реактивности. Несмотря на это, они все равно имеют важное значение в различных областях науки и промышленности, благодаря своим уникальным свойствам и химической активности.
Интересные факты о водороде

1. Самый легкий элемент: Водород является самым легким и наименее плотным элементом в таблице Менделеева. Его атомный номер 1 и атомная масса примерно равна 1,00784 унифицированных атомных масс (u).
2. Высокая теплопроводность: Водород обладает высокой теплопроводностью, что означает, что он способен передавать тепло с большой скоростью. Из-за этого свойства его часто используют в промышленности и в процессе охлаждения электрических генераторов и турбин.
3. Является частью воды: Водород является неотъемлемой частью молекулы воды. Каждая молекула воды состоит из двух атомов водорода и одного атома кислорода.
4. Источник энергии: Водород может быть использован в качестве источника энергии. При сжигании водорода в аэродинамической среде образуется вода, и при этом выделяется большое количество тепловой энергии.
5. Важный элемент в космическом исследовании: Водород играет важную роль в космическом исследовании, так как является частью главных компонентов во многих ракетах и космических средствах передвижения. Он используется как топливо и окислитель в ракетных двигателях.
6. Необычное поведение: Водород обладает необычным поведением при очень низких температурах, приближающихся к абсолютному нулю. При таких условиях водород становится суперпроводником, способным передавать электрический ток без сопротивления.
7. Изоляция водорода: Водород может быть изолирован с помощью различных методов, таких как электролиз, пароконденсационный метод и метод с электрической печью. Это делает его доступным для использования в разных сферах, таких как производство удобрений и химических реакций.
8. Сырье для производства аммиака: Водород является основным сырьем для производства аммиака, который используется в производстве удобрений и других химических процессах.
9. Потенциальное топливо будущего: Водород рассматривается как потенциальное топливо будущего, так как при его сжигании выделяется только вода и не происходит выброса углекислого газа или других вредных веществ.
10. Водородные соединения: Водород образует многочисленные соединения со многими элементами, включая углерод, кислород, азот и железо. Некоторые из этих соединений, таких как водородный пероксид и аммиак, имеют широкое применение в медицине, химической промышленности и других отраслях деятельности.
Реакция металлов с водородом: что происходит?

Реакция металлов с водородом является весьма интересным и важным явлением в химии. Во время этой реакции происходит образование гидридов металлов, которые представляют собой соединения металла с водородом.
Реакция металлов с водородом происходит при нагревании металла в присутствии водорода или при взаимодействии металла с водородом в растворе. В результате образуется соединение, в котором водород выступает как отрицательный ион, а металл как положительный ион.
Образование гидридов металлов имеет ряд особенностей. Некоторые металлы образуют гидриды, которые являются стабильными и используются в промышленности. Другие металлы могут образовывать нестабильные гидриды, которые разлагаются при нагревании или взаимодействии с водой.
Реакция металлов с водородом имеет много применений. Например, гидриды металлов используются в качестве средств хранения и переноса водорода. Также реакция металлов с водородом может применяться в процессах очистки воды и в производстве энергии.
Вопрос-ответ

Чем отличаются щелочные металлы от щелочноземельных?
Щелочные металлы включают натрий, калий, рубидий, цезий и франций, которые обладают одной валентной электронной оболочкой и характеризуются металлическим свойством. Щелочноземельные металлы, такие как магний, кальций, стронций, барий и радий, имеют две валентные электронные оболочки и обладают более металлическими свойствами.
Какие свойства имеют щелочные металлы?
Щелочные металлы имеют низкую плотность и мягкость, они хорошо проводят тепло и электричество. Они реагируют с водой, выделяя водород и образуя щелочные растворы. Кроме того, они образуют соли с кислотами и обладают химической активностью.
Зачем нужен водород и как он получается?
Водород является важным элементом в промышленности и науке. Он используется в производстве аммиака, металлов, пластмасс и воды. Водород может быть получен из различных источников, включая воду и газ. Процессы получения водорода включают электролиз, паровую реформацию и термохимические методы.
Как водород связан с щелочными металлами и щелочноземельными металлами?
Водород может образовывать соединения с щелочными металлами и щелочноземельными металлами. Некоторые из них включают гидриды щелочных металлов и гидриды щелочноземельных металлов. Гидриды щелочных металлов являются ионными соединениями, в которых анионом является водород, а катионом - металл. Гидриды щелочноземельных металлов образуются при реакции металла с водородом.
Какие применения имеет водород?
Водород используется как источник энергии в топливных элементах и водородных двигателях. Он также используется в процессе производства аммиака, металлов, пластмасс и воды. Кроме того, водород может использоваться в качестве ракетного топлива и средства хранения энергии.
