Водород является самым легким элементом в периодической системе. Он также обладает высокими энергетическими свойствами и может образовывать соединения с различными веществами, включая металлы. Взаимодействие водорода с металлами играет важную роль в таких процессах, как производство металлов, хранение энергии и катализ химических реакций.
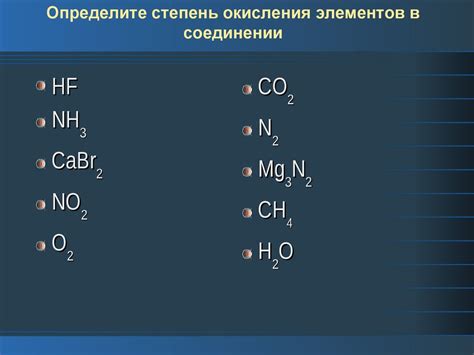
Степень окисления водорода в соединениях с металлами определяется числом, которое показывает, сколько электронов было передано от водорода к металлу во время образования соединения. Водород может образовывать соединения с положительной или отрицательной степенью окисления в зависимости от ситуации. Окиснителем может выступать как водород, так и металл.
Взаимодействие водорода с металлами обладает большой практической значимостью. Например, водород может использоваться в процессе обогащения титана, или в процессе нитрирования металла. Кроме того, водородная связь между молекулами водорода и металлами может приводить к образованию различных структурных состояний, включая металлический гидридный фазовый балл и типичный полимерный водородный балл, оба обладая уникальными свойствами и приложениями.
Связь между водородом и металлами: степень окисления водорода
Водород является химическим элементом, который может образовывать связи с различными металлами. При таких связях водород может проявлять различные степени окисления, что влияет на его реактивность и свойства.
Степень окисления водорода указывает, сколько электронов этот элемент передает в процессе связывания с металлом. Если водород отдает электроны, то его степень окисления будет положительной. Если же водород принимает электроны, то его степень окисления будет отрицательной.
Водород может образовывать два типа связей с металлами: ионную и ковалентную. В ионной связи металл отдает электроны, образуя положительно заряженный ион, а водород принимает электроны, образуя отрицательно заряженный ион. В ковалентной связи электроны между водородом и металлом распределяются равномерно.
Связь водорода с металлами имеет множество применений. Например, водородная связь между водородом и металлом может использоваться в качестве катализатора в различных химических реакциях. Кроме того, водород может быть использован в процессе производства энергии, особенно водородные топливные элементы, где водород связан с металлами, такими как платина или никелевый сплав.
Роль водорода в реакциях с металлами

Водород - химический элемент, который активно вступает в реакции с многими металлами. Его роль в этих реакциях может быть разнообразной и зависит от его степени окисления. В зависимости от условий реакции и химических свойств металла, водород может проявляться как окислитель, восстановитель или формировать гидриды.
Когда водород вступает в реакцию с металлами, его основная цель - найти новый электронный партнёр и достичь более стабильного состояния. В реакциях с некоторыми металлами, такими как литий или натрий, водород обладает окислительными свойствами и переходит в состояние с положительным зарядом, т.е. в степень окисления +1.
С другой стороны, в реакциях с некоторыми другими металлами, водород является восстановителем. Он принимает электроны от металла и переходит в состояние с отрицательным зарядом. Так, например, в реакции с алюминием, водород приобретает степень окисления -1 и образует гидрид алюминия (AlH₄).
Кроме того, водород способен образовывать гидриды с многими металлами, в которых его степень окисления равна нулю. Гидриды могут быть использованы в различных областях, таких как топливные элементы, сплавы и катализаторы, благодаря своим уникальным свойствам, включая высокую энергетическую плотность и низкую плотность вещества.
Таким образом, роль водорода в реакциях с металлами может быть разнообразной и зависит от множества факторов, включая условия реакции, химические свойства металлов и степень окисления водорода. Изучение этих реакций имеет большое практическое значение и помогает в разработке новых материалов и промышленных процессов.
Способы определения степени окисления водорода

1. Метод электрохимического определения степени окисления водорода
Один из способов определения степени окисления водорода основан на его электрохимической активности. Для этого используется электрохимическая ячейка, в которой вода разлагается на водород и кислород. После этого, с помощью специальной аппаратуры и измерений, можно определить степень окисления водорода.
2. Метод гравиметрического определения степени окисления водорода
Гравиметрический метод определения степени окисления водорода основан на его массе. Для этого, в данном методе, водород комплексируется с другими соединениями или металлами, после чего масса полученного соединения или металла определяется. Используя полученные данные, можно вычислить степень окисления водорода.
3. Метод спектроскопического определения степени окисления водорода
Спектроскопический метод позволяет определить степень окисления водорода по изменению его энергетических уровней. При этом измеряется энергия фотонов, испускаемых или поглощаемых водородом, и по полученным данным определяется степень окисления.
4. Метод вольтамперометрического определения степени окисления водорода
Вольтамперометрический метод основан на измерении вольт-амперной характеристики процесса окисления водорода. Для этого используется вольтамперометр, который позволяет измерить разность потенциалов на электродах при окислении водорода. Используя полученные данные, можно определить степень окисления водорода.
Таким образом, существует несколько способов определения степени окисления водорода, каждый из которых основан на различных принципах и методах измерений. Каждый метод имеет свои преимущества и может быть применен в зависимости от конкретной задачи и условий эксперимента.
Применение водорода с металлами в промышленности и научных исследованиях
Водород с металлами имеет широкое применение в различных сферах промышленности и научных исследованиях. Это связано с уникальными свойствами водорода, такими как низкая плотность, большая энергетическая плотность и возможность использования в качестве энергетического носителя.
Водород с металлами широко применяется в процессах производства и хранения энергии. Например, водород используется в гидрогенераторах для производства электроэнергии. Он также может быть использован в качестве топлива для автомобилей, а также в процессах синтеза и преобразования различных химических веществ.
Водород с металлами также активно применяется в научных исследованиях. Например, водородные свойства металлов могут быть использованы для создания новых материалов с уникальными физическими и химическими свойствами. Кроме того, водород применяется в качестве реактивного газа для проведения различных химических реакций и синтеза новых соединений.
В области энергетики водород с металлами играет важную роль. Он может быть использован в процессах производства водородной энергии, которая считается одним из наиболее чистых и эффективных источников энергии. Водород с металлами также может быть использован в процессах хранения и транспортировки энергии. Это позволяет эффективно использовать возобновляемые источники энергии, такие как солнечная и ветровая энергия.
В целом, применение водорода с металлами в промышленности и научных исследованиях имеет большой потенциал для создания новых технологий и решения актуальных проблем, связанных с энергетикой и окружающей средой. Благодаря уникальным свойствам водорода и возможности его комбинирования с металлами, можно достичь значительных прогрессов в области энергетики и материаловедения.
Вопрос-ответ

Какие металлы могут образовывать соединения с водородом?
Многие металлы могут образовывать соединения с водородом, включая литий (Li), натрий (Na), калий (K), магний (Mg), алюминий (Al), цинк (Zn), железо (Fe) и другие.
Что такое степень окисления водорода?
Степень окисления водорода в химическом соединении - это число, которое обозначает, сколько электронов водород переходит на окислителя или акцептор электронов. Например, в NaH степень окисления водорода равна -1.
Каким образом образуются соединения водорода с металлами?
Соединения водорода с металлами образуются путем реакции водорода с металлом. Водород может либо быть окислен, отдавая электроны металлу, либо акцептировать электроны от металла, приобретая положительную степень окисления. Образование таких соединений обычно сопровождается выделением тепла и образованием газа.
Какие свойства имеют соединения водорода с металлами?
Соединения водорода с металлами обычно являются солями или гидридами. Они обладают высокой электропроводностью и обычно являются хорошими проводниками тепла. Эти соединения могут образовывать газы, которые могут быть взрывоопасными в определенных условиях.
