Водород - первый элемент периодической системы, химический символ которого H. Он является самым легким элементом и самым распространенным в природе. Водород обладает уникальными свойствами, что вызывает споры среди ученых - можно ли его отнести к металлам или неметаллам.
С одной стороны, водород обладает металлическими свойствами. Он способен проводить электрический ток и тепло, что является характеристиками металлов. При низких температурах водород может образовывать металлические гидриды, которые проявляют свойства металлов.
Однако, с другой стороны, водород обладает и неметаллическими свойствами. Он не обладает блеском и не образует ионов с положительным зарядом, что является характеристикой неметаллов. Также водород образует соединения с другими неметаллами и обладает хорошей кислотностью.
Таким образом, ученые все еще не пришли к однозначному ответу - водород можно ли отнести к группе металлов или неметаллов. Однако его уникальные свойства и широкое применение делают этот элемент очень важным в нашей жизни.
Водород: металл или неметалл?

Водород – это химический элемент, который находится в первой группе и первом периоде периодической таблицы. Он наименее плотный и наиболее легкий из известных нам элементов. Возникает в результате ядерных реакций в звездах и является наиболее распространенным элементом во Вселенной.
Первоначально водород был классифицирован как металл, но позже эта классификация стала вызывать сомнения. Сегодня большинство ученых считает водород неметаллом из-за его низкой электроотрицательности и отсутствия металлических свойств, таких как блеск и проводимость тепла и электричества.
Водород часто используется в промышленности, особенно в производстве аммиака и металлов. Он также может быть использован в качестве палива для различных технологий, включая водородные топливные элементы.
Водород имеет два изотопа: легкий водород (протий) и тяжелый водород (деутерий). Их наличие в воде может быть представлено формулой H₂O, где H представляет водород, а O - кислород. Высший оксид воды – это молекула H₂O₂, более известная как перекись водорода. Она используется в медицине, отбеливателях и других промышленных процессах.
Химические свойства водорода
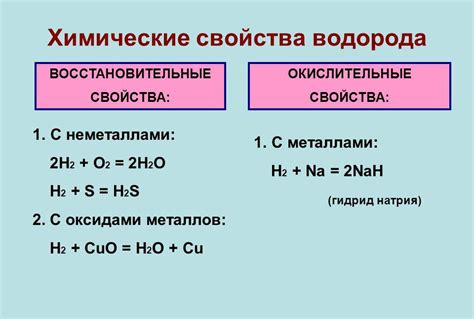
Водород – самый легкий элемент в периодической системе, который обладает уникальными химическими свойствами. Его атом состоит из одного протона и одного электрона. Водород неподвижен на воздухе и химически не реагирует с большинством элементов.
Однако, водород обладает большой реакционной способностью. Он легко реагирует с активными неметаллами (например, с кислородом, хлором и фтором), образуя соединения, такие, как воды и соли. Взаимодействие водорода с кислородом в присутствии катализатора приводит к образованию воды – самого распространенного и важного оксида в природе.
Водород также может образовывать соединения с металлами, образуя гидриды. Гидриды представляют собой соединения водорода с другими элементами, в которых водород выступает в роли отрицательно заряженного иона. Одним из примеров таких соединений является гидрид натрия (NaH).
Важным свойством водорода является его горючесть. Водород сгорает в присутствии кислорода с ярким пламенем и образованием воды. Именно возможность использования водорода в качестве источника энергии делает его таким перспективным и интересным для различных отраслей промышленности и научных исследований.
Физические свойства водорода

1. Атомный номер и молярная масса: Водород является первым элементом в таблице элементов Менделеева. Его атомный номер равен 1, а молярная масса около 1 г/моль.
2. Фазовое состояние: При стандартных условиях (температура 25°C, давление 1 атм) водород находится в газообразном состоянии. Однако при очень низких температурах (-260°C) и высоких давлениях водород может переходить в жидкую или твердую фазы.
3. Плотность: Плотность водорода в газообразном состоянии составляет около 0,089 г/см³. Она является самой низкой из всех элементов.
4. Температура кипения и плавления: Температура кипения водорода составляет около -252,8°C, а температура плавления при давлении 1 атм -259,2°C.
5. Растворимость: Водород является газообразным элементом, поэтому он практически не растворим в воде или других жидкостях. Однако он может растворяться в некоторых металлах, образуя так называемый металлический водород.
6. Газовые свойства: Водород обладает рядом важных газовых свойств. Он является легким газом, менее плотным, чем воздух. Водород не имеет цвета и запаха, и является негорючим, хотя является хорошим средством поджигания для других веществ.
7. Термические свойства: Водород обладает хорошей теплопроводностью и низкой теплоемкостью. Также он обладает низкой температурой замерзания, что делает его полезным для применения в криогенных технологиях.
8. Изотопы: Водород имеет три изотопа: протий, дейтерий и тритий. Натуральный водород состоит преимущественно из протия (около 99,98%), но дейтерий и тритий находят свое применение в ядерной энергетике и других областях науки и техники.
9. Химическая активность: Водород является очень реактивным элементом. Он может образовывать соединения с большинством других элементов, включая металлы и неметаллы. Водород также может реагировать с кислородом и образовывать высшее оксид воды (H₂O).
10. Пламя и пламенение: Водород, при взаимодействии с кислородом, горит воздушным пламенем с яркой желтой окраской и очень высокой температурой. Это делает его полезным в промышленности для использования в сварке, резке и других процессах.
Формула высшего оксида H₂O

Формула высшего оксида H₂O соответствует составу вещества, которое широко известно в нашей повседневной жизни под названием вода. Она состоит из двух атомов водорода (H) и одного атома кислорода (O), объединенных с помощью ковалентных связей.
Эти атомы образуют структуру молекулы воды, где атом кислорода занимает центральное положение, а атомы водорода располагаются с обеих сторон. Фиксированный угол между атомами водорода составляет приблизительно 104,5°.
Формула высшего оксида H₂O подчеркивает наличие ковалентных связей между атомами водорода и кислорода. Вода является одним из наиболее распространенных и важных веществ, необходимых для поддержания жизни на Земле. Она обладает уникальными свойствами, такими как высокая теплоемкость, крупные тепловые испарения и жидкое агрегатное состояние при комнатной температуре.
Формула H₂O важна для понимания химических свойств воды и ее реакций с другими веществами. Она помогает установить соотношение между атомами водорода и кислорода в молекулах воды и показывает, что водород является неметаллом, а кислород - металлом.
Вопрос-ответ

Является ли водород металлом или неметаллом? Как определить его класс?
Водород является химическим элементом, обладающим особыми свойствами и классифицируется как неметалл. Классификация осуществляется на основе его электрохимических и физических свойств.
Какие свойства водорода позволяют отнести его к неметаллам?
Основные характеристики водорода, определяющие его неметаллическую природу, включают непроводимость электричества и тепла, газообразное состояние при нормальных условиях, высокую реактивность и низкую электроотрицательность.
Какова формула высшего оксида водорода? Является ли он кислотой или основанием?
Высший оксид водорода имеет формулу H₂O и называется водой. Это одна из наиболее известных и широко используемых веществ на Земле. Вода обладает свойствами кислоты и основания, что позволяет ей участвовать в различных химических реакциях.
Почему водород отнесен к неметаллам, если он обладает металлическими свойствами?
Водород отнесен к неметаллам из-за более выраженных неметаллических характеристик, таких как непроводимость электричества и высокая электроотрицательность. Несмотря на некоторые металлические свойства, такие как проводимость тепла и возможность образования ионов, неметаллические характеристики превалируют.
Почему вода является кислотой и основанием одновременно?
Вода обладает амфотерными свойствами, то есть она может проявлять как кислотные, так и основные свойства в различных реакциях. В кислотных реакциях вода может отдавать протоны, а в основных реакциях она может принимать протоны. Это позволяет воде быть и кислотой, и основанием одновременно.
