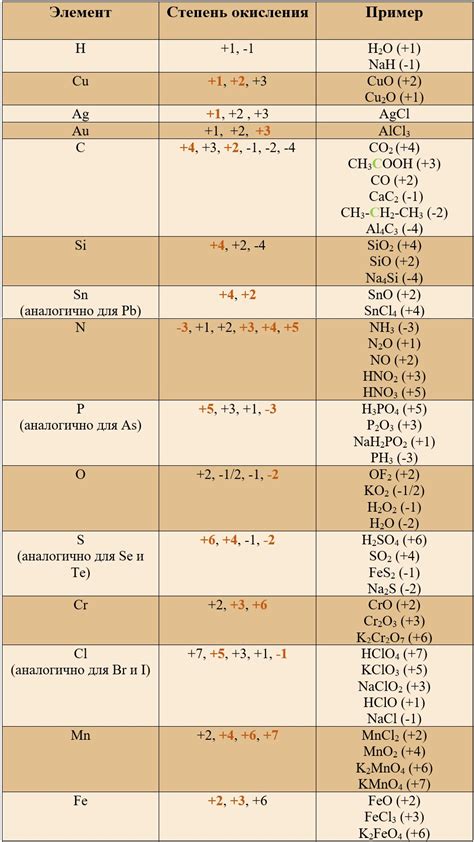
Водород – самый легкий элемент в периодической системе химических элементов, и он обладает уникальными свойствами. Одним из таких свойств является способность водорода к образованию химических соединений с различными элементами.
При сочетании с неметаллами и металлами водород проявляет степень окисления равную 1. Это значит, что водород делится на электроны таким образом, что его атом теряет один электрон и приобретает положительный заряд. Такое явление называется окислением.
Окисление водорода отражает его реактивность и способность вступать в химические взаимодействия с другими элементами. Сочетание водорода с неметаллами приводит к образованию соединений, называемых гидридами. Гидриды характеризуются высокой нестабильностью и взрывоопасностью.
С другой стороны, соединения водорода с металлами называются металлическими гидридами. Они обладают специфическими физическими и химическими свойствами, которые делают их применимыми в различных отраслях науки и техники.
Водород и его степени окисления

Водород - химический элемент, атомный номер которого равен 1. Он находится в первой группе периодической таблицы и имеет одну электронную оболочку. Водород может образовывать соединения со многими элементами, проявляя различные степени окисления.
Когда водород соединяется с неметаллами, он проявляет степень окисления равную 1. Например, водород образует воду (H2O), где он имеет степень окисления +1. Это связано с тем, что неметаллы обычно образуют отрицательные ионы, а водород образует положительные ионы.
В сочетании с металлами водород также проявляет степень окисления равную 1. Например, элементарный водород (H2) может реагировать с металлом натрием (Na) и образовывать натриевую соль (NaH), где водород имеет степень окисления +1.
Однако, в ряде случаев водород может проявлять и отрицательную степень окисления. Это связано с его способностью образовывать ионы гидрида (например, в соединении алюминийгидрид, AlH3, водород имеет степень окисления -1).
Водород и неметаллы

Водород - самый легкий элемент в периодической системе элементов. Он имеет валентность 1 и разнообразные химические свойства. В сочетании с неметаллами, водород обычно проявляет степень окисления равную 1.
Неметаллы - это элементы, которые имеют относительно высокую электроотрицательность и не обладают металлическими свойствами. Среди них мы можем выделить такие элементы, как кислород, азот, фтор, хлор и многие другие.
Сочетание водорода с неметаллами обычно приводит к образованию соединений, которые называются кислотами. Кислоты обладают кислотными свойствами и могут реагировать с основаниями, образуя соль и воду.
Примером сочетания водорода с неметаллом является образование воды. Вода, состоящая из молекул водорода и кислорода, является одним из наиболее распространенных веществ в природе и играет огромную роль в жизнедеятельности организмов на Земле.
Кроме воды, водород также образует аммиак (NH3), сероводород (H2S), фосфин (PH3) и другие соединения с неметаллами. Эти соединения имеют различные свойства и применяются в разных сферах науки и промышленности.
Водород и металлы

Водород – это элемент химической таблицы, который может образовывать различные соединения с другими элементами, включая металлы. Когда водород соединяется с металлами, он проявляет степень окисления равную 1.
Соединения водорода с металлами называют гидридами металлов. Гидриды металлов являются важными химическими соединениями и широко используются в различных областях, включая промышленность и энергетику.
Гидриды металлов с водородом обладают различными свойствами в зависимости от металла. Например, гидриды легких металлов, таких как литий и натрий, обладают высокой химической активностью и могут взаимодействовать с водой или влагой воздуха.
Гидриды тяжелых металлов, такие как палладий и платина, обладают специальными свойствами и широко используются в каталитических процессах, таких как синтез аммиака или очистка автомобильных выхлопных газов.
Таким образом, водород проявляет степень окисления равную 1 при соединении с металлами, и гидриды металлов являются важными соединениями, имеющими различные применения в различных областях науки и промышленности.
Степень окисления водорода при сочетании с неметаллами

Водород (H) является уникальным элементом, который образует соединения с различными неметаллами. В таких соединениях водород всегда проявляет степень окисления, равную 1. Это связано с тем, что водород обладает всего одним электроном во внешней оболочке.
Сочетание водорода с неметаллами приводит к образованию множества соединений, о которых известно человечеству. Например, водород сочетается с кислородом, образуя воду (H2O). При этом водород уступает свой электрон кислороду, что приводит к образованию иона H+.
При сочетании водорода с другими неметаллами, такими как сера (S), азот (N) или фтор (F), степень окисления водорода также равна 1. Например, водород сочетается с серой, образуя сероводород (H2S). В этом соединении водород отдает свой электрон сере, что приводит к появлению иона H+ в растворе.
Изучение степени окисления водорода при сочетании с неметаллами имеет важное практическое значение в химии. Это позволяет предсказывать свойства и реакционную способность соединений водорода с неметаллами, а также разрабатывать новые материалы и процессы на основе этих соединений.
Степень окисления водорода при сочетании с металлами
В химических соединениях водорода с металлами, степень окисления водорода обычно составляет 1. Это означает, что водород теряет один электрон, образуя положительный ион.
- Соединения водорода с щелочными металлами: в результате реакции водород образует гидриды, где степень окисления водорода равна 1. Примером такого соединения является гидрид натрия (NaH), где один атом водорода теряет один электрон и образует ион H-.
- Соединения водорода с щелочноземельными металлами: в этом случае степень окисления водорода также равна 1. Примером такого соединения является гидрид магния (MgH2), где два атома водорода теряют по одному электрону и образуют ионы H-.
- Соединения водорода с переходными металлами: при сочетании с переходными металлами степень окисления водорода также равна 1. Примером такого соединения является гидрид железа (FeH), где один атом водорода теряет один электрон и образует ион H-.
Водород является особенным элементом в периодической системе химических элементов, поскольку его степень окисления может изменяться в зависимости от особенностей реакции и химического соединения. Однако, при сочетании с металлами, степень окисления водорода всегда составляет 1.
Значение степени окисления водорода в химических реакциях
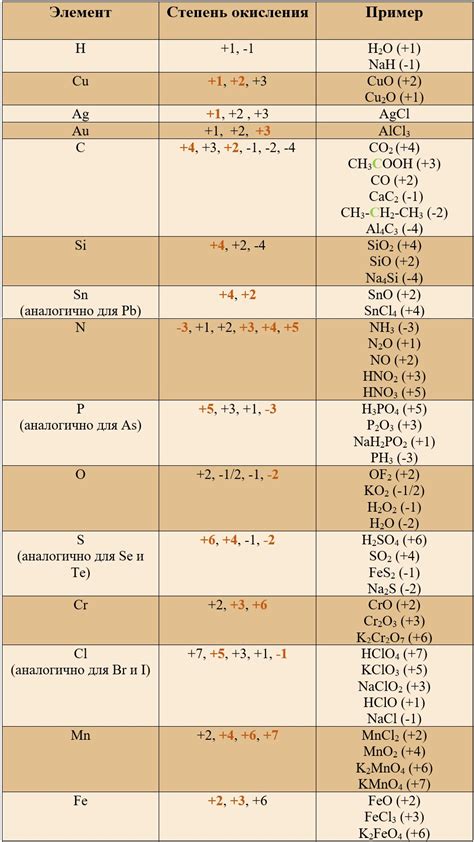
Водород, как элемент, может проявлять различные степени окисления в химических соединениях, изменяя свою электрохимическую активность. Одной из важных характеристик водорода является его способность образовывать соединения, в которых он проявляет степень окисления равную 1.
В сочетании с неметаллами, такими как кислород, сера, фтор, хлор, бром и азот, водород образует соединения, в которых его степень окисления равна 1-. Например, в соединении водорода с кислородом (вода), электроотрицательность кислорода больше, чем у водорода, что обусловливает его положительную степень окисления.
С другой стороны, в сочетании с металлами, водород также может проявлять степень окисления равную 1. В этом случае, водород образует ион водорода H+, который может образовывать кислоты в водных растворах. Например, в соединении водорода с металлом натрием (Na), водород проявляет отрицательную степень окисления, образуя ион H+. Это обуславливает кислотные свойства соединения.
Таким образом, значение степени окисления водорода в химических реакциях играет важную роль в определении свойств соединений, в которых он участвует. Это является основой для понимания реакций окисления и восстановления, а также характеристик кислотно-щелочного равновесия.
Степень окисления водорода и его применение в различных процессах

Водород - это химический элемент, который проявляет степень окисления равную 1 в сочетании с неметаллами и металлами. Это означает, что водород может донорировать или потерять один электрон при участии в химической реакции.
Степень окисления водорода делает его полезным во многих процессах. Водород является важным компонентом воды и многих органических соединений, таких как углеводороды. Благодаря своим химическим свойствам, водород может быть использован в различных областях науки и промышленности.
Одним из основных применений водорода является использование его в качестве топлива. Водородные топливные элементы (ВТЭ) используют водород для генерации электричества и производства тепла. Это экологически чистый и эффективный источник энергии, который не выделяет вредных выбросов в атмосферу.
Еще одним важным применением водорода является его использование в промышленных процессах. Водород используется в качестве реактивного газа при производстве аммиака, метанола, фреона и других химических соединений. Он также является основным компонентом водородной перекиси, которая широко используется в медицине, стоматологии и косметике.
Водород также может быть использован в качестве среды для хранения энергии. Водородные батареи и системы хранения позволяют эффективно сохранять энергию, полученную из возобновляемых источников, таких как солнечная и ветровая энергия. Это может быть удобным решением для обеспечения энергией в удаленных и недоступных местах.
Таким образом, степень окисления водорода и его химические свойства позволяют ему играть важную роль в различных процессах. Он применяется в топливных элементах, промышленности и системах хранения энергии, способствуя экологической устойчивости и энергетической эффективности.
Вопрос-ответ

Какая степень окисления у водорода в сочетании с неметаллами?
Водород проявляет степень окисления равную 1 в сочетании с неметаллами.
Какая степень окисления у водорода в сочетании с металлами?
Водород проявляет степень окисления равную 1 в сочетании с металлами.
Какие вещества образуются при сочетании водорода с неметаллами?
При сочетании водорода с неметаллами образуются вещества, в которых водород имеет степень окисления равную 1.
