Вода — это одно из основных веществ, которое мы используем в повседневной жизни. Она является не только неотъемлемой частью нашего организма, но и играет важнейшую роль во многих химических реакциях. Однако, мало кто задумывается о том, что вода может выполнять функцию растворителя и даже быть «кислотой» для металла.
Металлы, такие как железо, алюминий или медь, имеют реакционную способность к воде. При контакте с водой происходит окислительно-восстановительная реакция, в результате которой образуется водород и растворяются ионы металла в воде. При этом металл может претерпевать коррозию, что приводит к его разрушению и образованию окислов или солей металла.
Коррозия металлов в воде может происходить быстро или медленно в зависимости от сложности окружающей среды. Наличие различных примесей, таких как соли или кислоты, может ускорить или замедлить процесс коррозии. Так, кислотные растворы воды повышают скорость реакции металла с водой, поскольку они содержат ионы, которые образуются при диссоциации кислоты и реагируют с металлом.
Роль воды в химических процессах

Вода является одним из основных растворителей, используемых в химических процессах. Ее уникальные химические и физические свойства делают ее идеальным средством для реакций, происходящих между различными веществами. Вода способна растворять большое количество различных веществ, что позволяет ей играть важную роль в обмене веществ в организмах живых организмов.
Вода также является прекрасным реагентом во многих химических реакциях. Она может действовать как окислитель и восстановитель, а также участвовать в гидролизе и образовании гидратов. Благодаря своей полярности и способности образовывать водородные связи, вода способна взаимодействовать с различными химическими соединениями, образуя новые соединения и изменяя их структуру и свойства.
Вода также играет важную роль в реакциях окисления и восстановления. Она может выступать в качестве донора или акцептора электронов, что позволяет ей участвовать в многих ферментативных реакциях, происходящих в организмах. Благодаря этому, вода способна участвовать в процессах дыхания, фотосинтеза и других метаболических процессов, обеспечивая энергетические потоки и поддерживая жизнедеятельность организмов.
Таким образом, вода играет важную и неотъемлемую роль в химических процессах. Ее свойства и способность взаимодействовать с другими соединениями позволяют ей выполнять различные функции в организмах живых существ и обеспечивать нормальное функционирование химических систем.
Вода как растворитель

Вода является универсальным растворителем, благодаря своей способности образовывать водородные связи с другими веществами. Это позволяет ей эффективно растворять множество различных веществ, включая соли, кислоты, щелочи, газы и другие химические соединения.
Вода способна образовывать ионы, разделяющиеся на положительно и отрицательно заряженные частицы, что делает ее хорошим растворителем для солей. Когда соль растворяется в воде, ее молекулы разделяются на ионы, окруженные гидратационной оболочкой из водных молекул.
Вода также является кислотой, которая может реагировать с металлами. Металлы активными веществами растворяются в воде, образуя ионы металла и освобождая водород. Это происходит благодаря тому, что вода может выступать в роли окислителя, принимая электроны от металла.
Кроме того, вода может также действовать как растворитель для кислот и щелочей. Кислоты растворяются в воде, образуя ионы водорода (H+) и отрицательно заряженные ионы. Щелочи, напротив, образуют ионы гидроксида (OH-) и положительно заряженные ионы.
В целом, вода играет важную роль как растворитель в химических реакциях, происходящих в нашей повседневной жизни. Благодаря своим особым свойствам и способности взаимодействовать с различными веществами, она позволяет нам получать растворы с разными свойствами и применять их в различных областях, начиная от химической промышленности и заканчивая медициной и пищевой промышленностью.
Вода как кислота
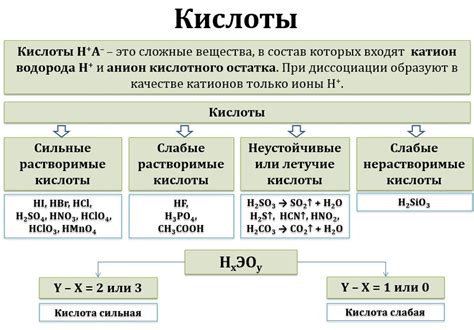
Вода является уникальным веществом, которое может выполнять различные химические реакции. Одной из таких реакций является проявление свойств кислоты. Вода может выступать в роли кислоты, когда взаимодействует с определенными веществами, в том числе с металлами.
Когда металл вступает в контакт с водой, возникает химическая реакция, в результате которой образуются ионы. Вода отдаёт один электрон металлу, превращаясь в ион водорода (H+). Такая реакция называется окислительно-восстановительной реакцией, и в данном случае вода действует как окислительные средство, а значит - как кислота.
Реакция воды с металлами может привести к образованию водорода и металлического гидроксида. Например, реакция цинка (Zn) с водой приводит к образованию иона цинка (Zn2+), иона водорода (H+) и металлического гидроксида цинка (Zn(OH)2).
Вода, как и кислота, имеет коррозивные свойства и может приводить к повреждению металлической поверхности. Поэтому при длительном контакте металла с водой возможно образование ржавчины или других окислов, что может привести к разрушению металлических конструкций.
Реакция воды с металлами

Вода является растворителем, способным производить реакции с различными металлами. Эти реакции могут быть как пассивными, так и активными в зависимости от свойств металла и условий реакции.
Пассивная реакция воды с металлами наблюдается у таких элементов, как золото и платина. Вода не обладает достаточной активностью для взаимодействия с ними и не вызывает коррозии или образования оксидных пленок на их поверхности.
Активная реакция воды с металлами происходит у элементов, таких как натрий, калий, литий и алюминий. Вода выступает как окислитель и реагирует с металлами, образуя гидроксиды и выделяя водород. Например, реакция натрия с водой протекает по следующей схеме:
- Натрий реагирует с молекулами воды, образуя гидроксид натрия и освобождая молекулы водорода.
- Реакция идет с выделением тепла и является сильно экзотермической.
- Образовавшийся гидроксид натрия распадается на [Na+] и [OH-].
- Освобождающийся водород может возгораться на воздухе при наличии источника зажигания.
Такие активные реакции воды с металлами могут использоваться в различных областях, включая производство водорода и его использование в энергетике.
Вода и реакция с щелочными металлами
Щелочные металлы (литий, натрий, калий и т.д.) обладают высокой реакционной способностью и способны подвергаться реакции с водой. Вода, в свою очередь, может выступать в качестве растворителя для этих металлов.
При реакции воды с щелочными металлами происходит образование оксидов металлов и выделение водорода. Например, реакция натрия с водой приводит к образованию оксида натрия (Na2O) и выделению водорода (H2):
- 2Na + 2H2O → 2NaOH + H2
При этом, вода действует как окислитель, получая электроны от металла и превращаясь в гидроксид металла. В результате образуется щелочная соль (гидроксид металла), которая растворяется в воде:
- 2NaOH + H2O → Na2O + 2H2O
Металл, в свою очередь, окисляется при контакте с водой и выделяет электроны, которые переходят на атомы кислорода воды:
- 2Na + 2H2O → 2NaOH + H2
Таким образом, реакция воды с щелочными металлами наглядно иллюстрирует характеристики воды как растворителя и ее влияние на взаимодействие с металлами, особенно в щелочной среде.
Вода и реакция с неметаллическими металлами
Вода может реагировать с неметаллическими металлами, приводя к образованию оксидов. Эти реакции могут быть как спонтанными, так и происходить при нагревании или взаимодействии с катализаторами.
Например, реакция водорода с кислородом приводит к образованию воды. Данная реакция является экзотермической и сопровождается выделением большого количества тепла. Водород может быть получен путем электролиза воды или взаимодействия металлов с кислородом.Эта реакция может быть фазообразующей.
Другой пример реакции воды с сероводородом. В результате этой реакции образуется сероводородная кислота. Сероводород можно получить путем нагревания серы с металлами. Также известна реакция воды с азотной кислотой, в результате которой образуется хлорная кислота и аммиак.
Можно также отметить реакцию воды с фосфором, при которой образуется фосфорная кислота, а также реакцию воды с угольным монооксидом, после чего образуется мочевина.
Таблица ниже показывает некоторые реакции воды с неметаллическими металлами:
- Водород + кислород -> вода
- Сера + металл -> сероводород
- Фосфор + вода -> фосфорная кислота
- Азотная кислота + вода -> хлорная кислота + аммиак
- Угольный монооксид + вода -> мочевина
Вода и реакция с тугоплавкими металлами
Вода – универсальный растворитель, способный взаимодействовать с многими веществами, включая металлы. Однако, не все металлы реагируют с водой без особых трудностей. Тугоплавкие металлы, такие как алюминий, магний и цинк, проявляют специфическое поведение в контакте с водой.
При контакте с водой, тугоплавкие металлы начинают активно реагировать, выделяя газы и нагреваясь. Например, при погружении кусочка алюминия в воду, можно наблюдать выделение пузырьков гидрогена и повышение температуры. Это связано с тем, что при реакции вода окисляет тугоплавкие металлы, а выделяющийся гидроген может быть возгораемым.
Реакция между водой и тугоплавкими металлами происходит по следующей схеме: металл + вода → гидроксид металла + гидроген. Например, при реакции алюминия с водой образуется гидроксид алюминия и гидроген:
- 2 Al + 6 H2O → 2 Al(OH)3 + 3 H2
Полученный гидроксид металла образует пленку на поверхности металла, которая защищает его от дальнейшего взаимодействия с водой. Однако, тугоплавкие металлы покрыты оксидной пленкой, которая нарушает контакт с водой, поэтому реакция довольно медленная и требует дополнительных условий, таких как порошкообразное состояние металла или повышенная температура.
Таким образом, реакция воды с тугоплавкими металлами имеет свои особенности, связанные с образованием гидроксидов и гидрогена. Понимание этих особенностей позволяет контролировать взаимодействие металлов с водой и использовать это знание в различных технологических процессах.
Вопрос-ответ

Может ли вода являться растворителем для металлов?
Да, вода может являться растворителем для некоторых металлов. Она обладает способностью растворять металлы, особенно активные, и образовывать ионы металла и водорода.
Каким образом вода растворяет металлы?
Процесс растворения металлов в воде осуществляется путем взаимодействия воды с поверхностью металла и образования ионов металла и водорода. Вода действует как растворитель, образуя водород и ионы металла, которые растворяются в воде.
