Соляная кислота – это одна из самых распространенных и химически активных кислот. Она широко используется в промышленности, бытовых целях и научных исследованиях. Одним из ключевых вопросов, связанных с ее использованием, является ее способность растворять металлы. В данной статье мы рассмотрим, насколько соляная кислота способна взаимодействовать с металлическими поверхностями и какие факторы оказывают влияние на этот процесс.
В химии процесс растворения металлов в кислотах называется коррозией. Коррозия – это процесс окисления металла, при котором происходит его разрушение, образование солей и выделение водорода. Соляная кислота является сильным окислителем и имеет высокую растворимость в воде, что делает ее одной из наиболее сильных кислот. Поэтому она способна реагировать с многими металлами, образуя соли и выделяя водород. Однако не все металлы одинаково восприимчивы к влиянию соляной кислоты и скорость реакции может значительно варьироваться в зависимости от свойств металла и условий взаимодействия.
Факторы, влияющие на реакцию металла с соляной кислотой, включают его электрохимические свойства, структуру поверхности, концентрацию и температуру кислотного раствора, а также время взаимодействия. Например, активные металлы, такие как цинк или железо, легко реагируют с соляной кислотой и могут прореагировать даже с разбавленной ее концентрацией. В то же время некоторые металлы, такие как золото или платина, не реагируют с соляной кислотой при обычных условиях или реагируют очень медленно.
Что такое соляная кислота?
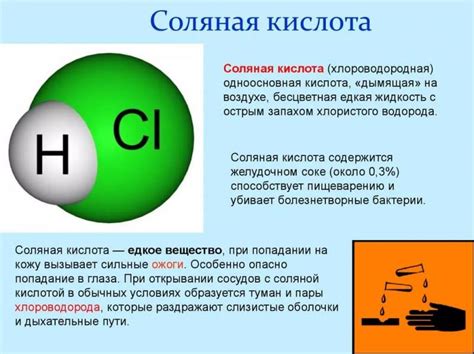
Соляная кислота (HCl) - бесцветная жидкость с сильным запахом, являющаяся одним из наиболее распространенных химических соединений. Она широко используется в промышленности, научных исследованиях, медицине и бытовых целях.
Соляная кислота обладает высокой степенью растворимости в воде, что делает ее хорошим сильным кислотным агентом. Кислотные свойства соляной кислоты проявляются в ее способности высвобождать положительные ионы водорода (H+) при контакте с водой.
Соляная кислота широко используется в промышленности, особенно в процессе производства химических соединений, как растворитель и реагент. Также она используется в бытовых целях, например, для удаления накипи и ржавчины с поверхностей.
Значительные количества соляной кислоты производятся в природе желудком животных, в том числе человека, где она играет важную роль в пищеварительном процессе. Однако в промышленных масштабах она производится синтетическим путем.
Соляная кислота является коррозионным агентом и может вызывать повреждение кожи, глаз и дыхательных путей при неправильном обращении. Поэтому при работе с ней необходимо соблюдать все предосторожности и использовать соответствующую защитную экипировку.
Физические свойства соляной кислоты

Соляная кислота (хлороводородная кислота, HCl) – это бесцветная жидкость с резким запахом, которая имеет высокую степень растворимости в воде. Ее плотность составляет около 1.18 г/см3, что делает ее более плотной, чем вода. Обычно, соляная кислота имеет концентрацию около 37%, но может быть и более или менее концентрированной.
Соляная кислота обладает высокой степенью летучести, что означает, что она быстро испаряется при комнатной температуре. Ее пары очень раздражают глаза и дыхательные пути, поэтому необходимо соблюдать осторожность при работе с ней.
Температура кипения соляной кислоты зависит от ее концентрации. Чем выше концентрация, тем выше температура кипения. При комнатной температуре концентрированная соляная кислота может образовывать дымки, которые состоят из паров кислоты и хлороводорода.
Соляная кислота является сильно коррозионным веществом и может реагировать с множеством материалов, включая некоторые металлы. Это объясняется тем, что она обладает сильными оксидирующими свойствами. Однако, некоторые металлы, такие как золото и платина, обладают высокой устойчивостью к соляной кислоте.
Еще одним важным физическим свойством соляной кислоты является ее способность образовывать гидраты. В зависимости от концентрации и температуры, соляная кислота может образовывать до 7 типов гидратов, где молекулы воды могут присоединяться к молекулам кислоты.
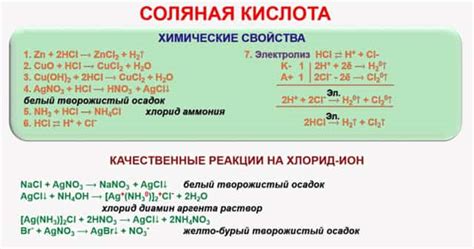
Химические свойства соляной кислоты

Соляная кислота (хлороводородная кислота) – это химическое соединение, которое образуется в результате реакции хлорида водорода и воды. Она является одной из наиболее распространенных и важных кислот в химии.
Соляная кислота обладает рядом химических свойств, которые делают ее полезной в различных областях. У нее сильно выраженные кислотные свойства – она может образовывать ион водорода (H+) в водном растворе. Именно эта способность позволяет соляной кислоте растворять многие металлы и их соединения.
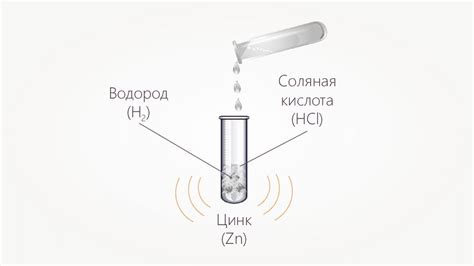
Когда соляная кислота взаимодействует с металлами, происходит реакция, в результате которой выделяются газы и образуются соли. Реактивность металлов со соляной кислотой может быть разной. Например, металлы, такие как магний и алюминий, реагируют с соляной кислотой, образуя соль и выделяя водородный газ. Другие металлы, такие как железо или медь, могут не реагировать с соляной кислотой, так как обладают ниже активностью.
Соляная кислота также является сильным окислителем. В реакциях с некоторыми веществами она может передавать кислород или принимать электроны, что приводит к изменению степени окисления данных веществ. Это свойство делает ее подходящей для использования в процессах окисления-восстановления.
Концентрация соляной кислоты может быть различной – от очень разбавленных растворов до высокой концентрации, которая может привести к серьезным химическим ожогам и разрушению материалов. Поэтому при работе с соляной кислотой необходимо соблюдать меры безопасности и работать в хорошо проветриваемом помещении.
Виды взаимодействия с металлами
Окисление - один из наиболее распространенных видов взаимодействия металлов с окружающей средой. При окислительных реакциях металлы вступают в химическую реакцию с кислородом, образуя окисные соединения.
Пример: железо под воздействием влаги и кислорода окисляется, образуя ржавчину.
Растворение - процесс, при котором металл переходит в раствор в виде ионов. Растворение металлов может происходить в различных средах, таких как кислоты, щелочи или соли.
Пример: соляная кислота растворяет металлы, такие как цинк или железо, образуя хлориды металлов.
Гальваническая коррозия - это вид взаимодействия, при котором разные металлы в контакте с влажной средой и электролитами могут образовывать гальванические элементы. При этом один металл служит анодом, а другой металл - катодом. Коррозия происходит за счет электрического тока, который возникает между анодом и катодом.
Пример: сочетание алюминия и стали может вызывать гальваническую коррозию, при которой алюминий будет служить анодом и растворяться в электролите, а сталь будет служить катодом.
Реакции с различными металлами

Соляная кислота – один из наиболее распространенных химических реагентов, используемых в промышленности и лабораторной практике. Ее характеристика – сильная кислотность, вызванная наличием в молекуле жестко закрепленного протона в гидроксильной группе. Интересно, что реакция соляной кислоты с различными металлами может протекать по-разному.
Сильные электроотрицательные металлы, такие как железо или алюминий, реагируют с соляной кислотой с образованием соли и выделением водорода. Эта реакция иллюстрирует активный металлический характер железа или алюминия, которые легко отдают электроны, образуя положительные ионы и генерируя высокоэнергетическую реакцию.
Химически инертные металлы, например золото или платина, не реагируют с соляной кислотой. Это связано с их низкой активностью и пассивностью. Фактически, соляная кислота не способна окислить или растворить такие металлы, поэтому они используются для хранения сильных кислот или других агрессивных химических соединений.
С древесными и окисленными металлами (например, ржавчиной) соляная кислота также реагирует, но реакция может быть менее интенсивной. Например, реакция с ржавчиной может привести к образованию железных солей и выделению газообразного водорода.
Коррозия и соляная кислота

Коррозия – это процесс разрушения материала под воздействием окружающей среды. Одной из распространенных причин коррозии является взаимодействие металлов с кислотами. Особенно активной считается соляная кислота.
Соляная кислота, также известная как хлороводородная кислота, обладает высокой степенью коррозионной активности. Ее действие на металлы основано на том, что кислота отнимает электроны у металлических элементов, образуя ионы в местах контакта кислоты и металла.
Самыми подверженными коррозии металлами под воздействием соляной кислоты являются железо, сталь, алюминий и медь. При этом скорость коррозии зависит от разных факторов, таких как концентрация кислоты, ее температура и продолжительность воздействия.
Чтобы защитить металлы от коррозии под воздействием соляной кислоты, часто применяется покрытие поверхности защитными материалами, такими как покрытие оксидов, пленки из полимеров или другие антикоррозийные покрытия.
Практическое применение соляной кислоты
В производстве
Соляная кислота широко применяется в различных отраслях промышленности. Она используется для очистки и обработки металлов, таких как железо и сталь. Кислота способна удалить окислы и другие загрязнения с поверхности металла, обеспечивая его высокую степень очистки.
В производстве удобрений
Соляная кислота является неотъемлемым компонентом для производства многих удобрений. Она используется для получения растворимых солей, которые содержат необходимые для растений элементы питания. Такие удобрения позволяют повысить урожайность и качество сельскохозяйственных культур.
В химической промышленности
Кроме того, соляная кислота применяется для производства различных химических соединений. Она используется в процессе получения хлорида водорода, которое в свою очередь является важным сырьем для производства промышленных кислот, пластмасс и многих других веществ.
В быту
Соляная кислота может быть использована для очистки и удаления различных загрязнений в быту, таких как ржавчина, накипь и известковый налет. Однако при использовании кислоты в бытовых условиях необходимо соблюдать меры безопасности, так как она является едким веществом.
Мера безопасности при работе с соляной кислотой

Работа с соляной кислотой требует соблюдения определенных мер безопасности, чтобы предотвратить потенциальные опасности и минимизировать риск для здоровья и безопасности.
Во-первых, необходимо использовать защитное снаряжение, такое как защитные очки, халат, резиновые перчатки и специальную фильтрующую маску для лица, чтобы предотвратить контакт с кислотой и ее испарениями.
При работе с соляной кислотой необходимо обеспечить хорошую вентиляцию рабочего места, чтобы избежать ее накопления в воздухе. Рекомендуется проводить работы с соляной кислотой только в специально оборудованных помещениях или под вытяжным шкафом.
В случае контакта с кожей или глазами необходимо тщательно промыть большим количеством воды и обратиться к врачу. При попадании кислоты на одежду необходимо сразу же снять ее и промыть зону контакта водой.
Также рекомендуется избегать взаимодействия с соляной кислотой и другими веществами, особенно с легковоспламеняющимися материалами или окислителями, так как это может вызвать опасные химические реакции.
Необходимо хранить соляную кислоту в специально обозначенных емкостях, вдали от детей и животных. Кроме того, при хранении кислоты следует избегать высоких температур и прямого солнечного излучения.
Соблюдение этих мер безопасности поможет предотвратить возможные риски и обеспечить безопасность при работе с соляной кислотой.
Вопрос-ответ

Может ли соляная кислота растворить любой металл?
Нет, соляная кислота не может растворить любой металл. Она способна растворять некоторые металлы, такие как цинк, железо и алюминий, но не может растворить драгоценные металлы, такие как золото и платину.
Как происходит растворение металла в соляной кислоте?
Растворение металла в соляной кислоте происходит посредством окисления металла и образования соли металла и хлороводородного газа. В процессе реакции металл выделяет электроны, которые окисляются, а хлороводородная кислота принимает электроны и выделяет атомарный водород.
Какие металлы растворяются в соляной кислоте?
В соляной кислоте растворяются такие металлы, как цинк, железо и алюминий. Реакция растворения металла в соляной кислоте обычно протекает очень быстро и сопровождается выделением пузырьков газа и образованием соли металла. Однако драгоценные металлы, такие как золото и платина, не растворяются в соляной кислоте и остаются незатронутыми.