Металлы являются активными элементами, способными образовывать соединения с различными веществами. Одним из действующих веществ, которое может реагировать с металлами, является разбавленная соляная кислота (HCl).
Соляная кислота – это бесцветная жидкость с резким запахом. Она состоит из воды (H2O) и хлороводородной кислоты (HCl). При взаимодействии с металлами происходит химическая реакция, в результате которой выделяется водородный газ (H2) и образуются соответствующие соли.
Некоторые металлы реагируют с соляной кислотой более активно, чем другие. Например, щелочные металлы (натрий, калий) быстро реагируют с HCl, образуя хлориды и выделяя водород. Алюминий, цинк, железо и некоторые другие металлы могут реагировать с разбавленной соляной кислотой, но реакция происходит медленнее и требует определенных условий.
Однако не все металлы реагируют с соляной кислотой. В том числе, такие металлы, как серебро, свинец и золото, не проявляют активность при взаимодействии с разбавленной соляной кислотой. Это связано с их низкой реакционной способностью и стабильностью.
Роль разбавленной соляной кислоты в химических реакциях

Разбавленная соляная кислота (ХCl) – одно из наиболее распространенных и важных химических соединений, широко применяемых в различных сферах деятельности. Она играет важную роль в химических реакциях, благодаря своим химическим свойствам и способности проявлять активность против различных веществ.
Соляная кислота может быть использована в реакциях нейтрализации для снятия щелочных веществ или веществ, обладающих щелочными свойствами. В результате реакции соляной кислоты с щелочными растворами, образуется соль и вода. Эта реакция является эффективным способом регулирования pH-уровня в различных системах и процессах.
Соляная кислота проявляет также свойства окислителя при взаимодействии с некоторыми веществами. Одним из примеров является реакция с металлами, в которой соляная кислота окисляет металл, образуя соответствующие соли и выделяя водород. Эта реакция может быть использована для получения важных продуктов химической промышленности, а также в химическом анализе для определения содержания металлов в различных образцах.
Важным применением разбавленной соляной кислоты является ее использование в качестве катализатора в различных химических процессах. С ней связаны такие процессы, как выделение газов (например, хлора) или производство важных органических соединений (например, этилена). Разбавленная соляная кислота взаимодействует с реагентами, повышая скорость реакции и обеспечивая химическую стабильность процесса.
Таким образом, разбавленная соляная кислота играет важную роль в химических реакциях, выполняя функции нейтрализатора, окислителя и катализатора. Ее применение находит широкое применение в различных отраслях промышленности и лабораторной практике, способствуя осуществлению множества химических процессов.
Химические свойства разбавленной соляной кислоты

Разбавленная соляная кислота (хлороводородная кислота) является одной из наиболее распространенных и активных неорганических кислот. Она обладает рядом химических свойств, которые определяют ее важное место в химической промышленности и лабораторных исследованиях.
Кислота обладает сильными кислотными свойствами, проявляющимися в возможности отдавать протоны раствору. Это позволяет соляной кислоте производить нейтрализацию щелочных растворов, образуя соль и воду. Кроме того, соляная кислота способна растворять множество металлов, образуя соли.
Соляная кислота обладает коррозионными свойствами и может разрушать металлы. Однако не все металлы реагируют с соляной кислотой одинаково. Некоторые металлы, такие как золото и платина, практически не реагируют с соляной кислотой, тогда как другие металлы, например, железо и цинк, растворяются с выделением водорода и образованием соответствующих солей.
Кроме реакций с металлами, соляная кислота может претерпевать различные химические превращения. Например, при нагревании она может деогидрироваться с образованием газообразного хлорида водорода и воды (взаимодействие с водой). Также, с помощью соляной кислоты можно проводить растворение различных неорганических и органических соединений, что применяется в лаборатории и химической промышленности.
Металлы, способные реагировать с разбавленной соляной кислотой

Реакция разбавленной соляной кислоты с металлами является химической реакцией, при которой выделяется водород. Однако, не все металлы способны реагировать с этой кислотой. Реактивность металлов зависит от их электрохимического потенциала и способности отдавать электроны.
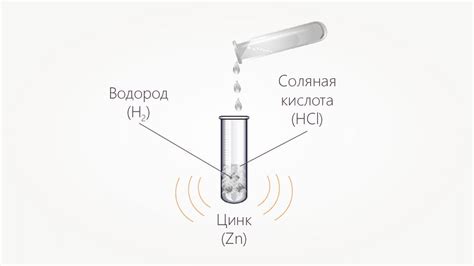
Одним из металлов, реагирующих с разбавленной соляной кислотой, является цинк. При контакте цинка с кислотой образуется хлорид цинка и выделяется водородный газ. Это реакция восстановления, в результате которой цинк отдает два электрона и образует ион цинка (Zn2+).
Другим металлом, способным реагировать с разбавленной соляной кислотой, является железо. Реакция железа с кислотой аналогична реакции цинка и приводит к образованию хлорида железа и выделению водородного газа. Однако, реакция железа происходит медленнее, чем реакция цинка.
Алюминий также реагирует с разбавленной соляной кислотой, но реакция протекает медленно и требует нагревания. При этом образуется алюминий хлорид и выделяется водородный газ.
Однако, некоторые металлы, такие как золото, серебро и платина, не реагируют с разбавленной соляной кислотой. Их электрохимический потенциал недостаточно высок для вступления в реакцию.
В таблице ниже приведены некоторые металлы, способные реагировать с разбавленной соляной кислотой:
| Металл | Химическая реакция |
|---|---|
| Цинк (Zn) | Zn + 2HCl = ZnCl2 + H2 |
| Железо (Fe) | Fe + 2HCl = FeCl2 + H2 |
| Алюминий (Al) | Al + 3HCl = AlCl3 + 1.5H2 |
Эти металлы, реагируя с разбавленной соляной кислотой, находят применение в различных процессах, таких как производство водорода или получение соответствующих металлических соединений.
Реакция соляной кислоты с щелочными металлами
Щелочные металлы – это металлы первой группы периодической системы, к которым относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой реактивностью и способностью образовывать соли щелочных металлов.
Реакция соляной кислоты с щелочными металлами происходит с выделением водорода и образованием соли. При этом образуется гидроксид металла и хлорид водорода. Реакция протекает по следующему уравнению:
2HCl + 2M → 2MCl + H2
Здесь HCl - соляная кислота, M - металл первой группы периодической системы.
Реакция щелочных металлов с соляной кислотой является экзотермической, то есть сопровождается выделением тепла. При ее проведении важно соблюдать предосторожность, так как образующийся водород является горючим и взрывоопасным газом.
Реакция соляной кислоты с щелочными металлами на практике используется для получения соответствующих солей. Например, реакция соляной кислоты с натрием приводит к образованию хлорида натрия, который широко применяется в химической промышленности и пищевой промышленности.
Реакция соляной кислоты с щелочноземельными металлами

Соляная кислота является одной из самых распространенных и сильных минеральных кислот. Она обладает высокой реакционной способностью и способна растворять различные материалы, включая металлы.
Взаимодействие соляной кислоты с щелочноземельными металлами такими, как магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba), происходит с образованием солей и выделением водорода.
Металлы щелочноземельных групп находятся во втором столбце периодической таблицы и характеризуются низкой электроотрицательностью. Когда они сталкиваются с соляной кислотой, происходит обмен протонами, в результате которого металлы образуют положительные ионы и высвобождаются атомы водорода.
Реакция соляной кислоты с щелочноземельными металлами может быть представлена следующим образом:
| Металл | Уравнение реакции |
| Магний (Mg) | Mg + 2HCl → MgCl2 + H2 |
| Кальций (Ca) | Ca + 2HCl → CaCl2 + H2 |
| Стронций (Sr) | Sr + 2HCl → SrCl2 + H2 |
| Барий (Ba) | Ba + 2HCl → BaCl2 + H2 |
Таким образом, щелочноземельные металлы реагируют с соляной кислотой, образуя соответствующие хлориды металлов и выделяя водород.
Реакция соляной кислоты с переходными металлами

Переходные металлы - это элементы, находящиеся в переходной группе периодической системы химических элементов. Примеры таких металлов включают железо (Fe), медь (Cu), цинк (Zn), никель (Ni) и многие другие.
Реакция соляной кислоты с переходными металлами может привести к образованию солей и выделению водорода. Переходные металлы обычно реагируют с соляной кислотой, образуя соответствующие соли и выделение водорода.
Например, реакция железа с соляной кислотой приводит к образованию хлорида железа (FeCl2) и выделению водорода. Эта реакция можно представить следующим уравнением:
Fe + 2HCl → FeCl2 + H2
Аналогично, реакция меди с соляной кислотой приводит к образованию хлорида меди (CuCl2) и выделению водорода:
Cu + 2HCl → CuCl2 + H2
Такие реакции соляной кислоты с переходными металлами позволяют использовать соляную кислоту как реагент для получения соответствующих солей переходных металлов.
Несмотря на то, что переходные металлы обычно реагируют с соляной кислотой, степень и скорость реакции могут зависеть от различных факторов, таких как концентрация кислоты, температура и состояние металла (чистота, форма).
Реакция соляной кислоты с редкоземельными металлами

Соляная кислота, также известная как хлороводородная кислота, это одна из наиболее распространенных и сильных минеральных кислот. Она обладает рядом уникальных свойств и активно применяется в химической промышленности и лабораториях. Одним из интересных аспектов реактивности соляной кислоты является ее взаимодействие с редкоземельными металлами.
Редкоземельные металлы представляют собой группу 17 элементов, которые обладают сходными химическими свойствами и похожим рядом валентности. Некоторые из них, такие как лантан, церий и неодим, широко используются в производстве различных электронных устройств, магнитных материалов и катализаторов.
Когда редкоземельные металлы встречаются с соляной кислотой, происходит реакция окисления металла. Cоляная кислота действует как окислитель, передавая электроны металлу. В результате образуются ионы металла с более высокой валентностью.
Эта реакция позволяет получать редкоземельные соли, которые имеют широкий спектр применения, включая использование в качестве катализаторов, добавок в сплавы, красок и других продуктов. Исследования в этой области продолжаются с целью улучшения эффективности и экономичности процессов получения редкоземельных металлов из природных источников.
Итак, взаимодействие соляной кислоты с редкоземельными металлами является важным аспектом исследований в области химической обработки металлов. Получение редкоземельных солей с использованием соляной кислоты открывает новые возможности в производстве и применении этих ценных металлов в различных отраслях промышленности.
Вопрос-ответ

Какие металлы реагируют с разбавленной соляной кислотой?
С разбавленной соляной кислотой реагируют некоторые металлы, такие как цинк, железо и алюминий. Эти металлы образуют с соляной кислотой соли и высвобождаются водород.
Почему только некоторые металлы реагируют с разбавленной соляной кислотой?
Некоторые металлы реагируют с разбавленной соляной кислотой потому, что они химически активны и обладают достаточной реакционной способностью. Другие металлы могут быть менее реактивными или иметь покрытие, которое препятствует реакции с кислотой.
Какова химическая реакция между разбавленной соляной кислотой и металлами?
Реакция между разбавленной соляной кислотой и металлами обычно происходит по следующему уравнению: Металл + 2HCl (соляная кислота) → Металлическая соль + H2 (водород). Например, реакция цинка с разбавленной соляной кислотой выглядит следующим образом: Zn + 2HCl → ZnCl2 + H2.
Есть ли металлы, которые не реагируют с разбавленной соляной кислотой?
Да, есть металлы, которые не реагируют с разбавленной соляной кислотой. Например, медь и серебро считаются химически инертными и не реагируют с соляной кислотой в обычных условиях.
