РН (реакция среды) – это одна из важнейших характеристик растворов, определяющая степень их кислотности и щелочности. Значение рН представляет собой численную меру активности водородных ионов (H+) в растворе. Среди веществ, способных образовывать растворы с различной реакцией, особую роль играют кислоты. Взаимодействие кислот с металлами имеет важное значение как в естественных, так и в технических процессах, однако зависимость величины рН от природы кислот и металлов является сложной и требует детального исследования.
Каждая кислота взаимодействует с металлами по-разному, и это обусловлено их структурой и химическими свойствами. Некоторые кислоты, например, сильные минеральные кислоты, такие как серная, хлорная или азотная, обладают сильными окислительными свойствами и могут растворять металлы при образовании солей и выделении водорода. Другие кислоты, например, уксусная или яблочная, могут растворять металлы намного медленнее и создавать менее активные растворы с низким уровнем водородных ионов.
Важно отметить, что при взаимодействии кислот с металлами образуются соли, которые могут иметь различную реакцию. Например, соли кислот имеют нейтральную реакцию, а соли слабых кислот – щелочную. Это демонстрирует влияние кислотного окружения на химические свойства солей и отражает важность определения природы кислот при работе с металлами.
Таким образом, понимание зависимости величины рН от природы кислот при взаимодействии с металлами является ключевым моментом в исследовании химических реакций и химической активности веществ. Систематическое исследование этой зависимости позволяет прогнозировать результаты реакций, оптимизировать условия процессов и создавать новые материалы с заданными химическими свойствами.
РН и его зависимость от кислот
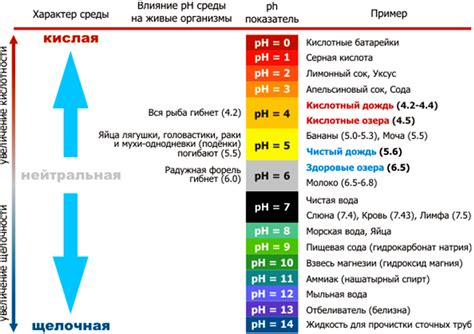
РН (показатель водородного ионного потенциала) является одним из основных показателей кислотности или щелочности вещества. Величина РН определяет концентрацию водородных ионов в растворе. Она измеряется по шкале от 0 до 14, где значение 7 соответствует нейтральной среде, значения меньше 7 - кислотной, а значения больше 7 - щелочной.
Зависимость величины РН от кислотности определяется силой и свойствами кислоты. Взаимодействие кислоты с веществами, такими как металлы, может вызывать изменения рН раствора.
Некоторые кислоты могут образовывать с металлами растворимые соли и выделять водород. Это связано с тем, что при взаимодействии кислоты с металлом ион водорода (Н+) выделяется из кислоты, а на его место образуется ион металла, который может быть растворимым или нерастворимым в растворе.
Таким образом, величина РН раствора будет зависеть от типа кислоты, свойств металла и его растворимости. Например, сильные минеральные кислоты (например, серная или хлороводородная) могут образовывать с металлами растворимые соли и вызывать сильное изменение РН раствора.
Важно учитывать, что при взаимодействии кислоты с металлом могут образовываться различные продукты, которые могут вносить дополнительные изменения в РН раствора. Процессы взаимодействия кислот и металлов являются важными для понимания химических реакций и их влияния на окружающую среду.
Влияние природы кислоты на значение РН
РН (показатель водородного потенциала) является мерой кислотности или щелочности раствора. Он определяет концентрацию катионов водорода (Н+) в растворе. Значение рН может быть кислотным (от 0 до 6), нейтральным (равное 7) или щелочным (от 8 до 14).
Одним из факторов, влияющих на значение рН раствора, является природа кислоты, с которой взаимодействует металл. Разные кислоты обладают различными свойствами и могут иметь различное воздействие на рН раствора.
Например, сильные минеральные кислоты, такие как серная кислота (H2SO4) или хлороводородная кислота (HCl), обладают высокой степенью диссоциации и могут мгновенно передавать свои протоны в раствор. Это приводит к низкому значению рН и образованию кислого окружения.
С другой стороны, слабые органические кислоты, такие как уксусная кислота (CH3COOH) или молочная кислота (C3H6O3), имеют низкую степень диссоциации и медленно отдают свои протоны в раствор. Это приводит к более высокому значению рН и образованию щелочного или нейтрального окружения.
Таким образом, природа кислоты может оказывать существенное влияние на значение рН раствора при взаимодействии с металлами. Применение данного знания позволяет учитывать этот фактор при проведении химических реакций или в процессе контроля качества продукции.
Взаимодействие кислот с металлами
Кислоты – это вещества, способные высвобождать положительные ионы в водном растворе. Они взаимодействуют с металлами, причиняя различные химические реакции. В процессе этого взаимодействия происходят изменения величины рН раствора, которые зависят от природы используемой кислоты.
Величина рН является мерой кислотности или щелочности раствора. Если кислоты реагируют с металлами, происходит образование соли и выделение водорода. При этом, величина рН раствора может увеличиваться или уменьшаться в зависимости от вида кислоты.
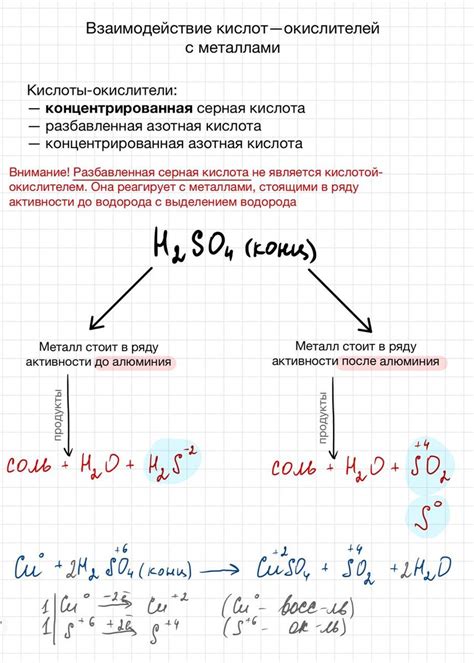
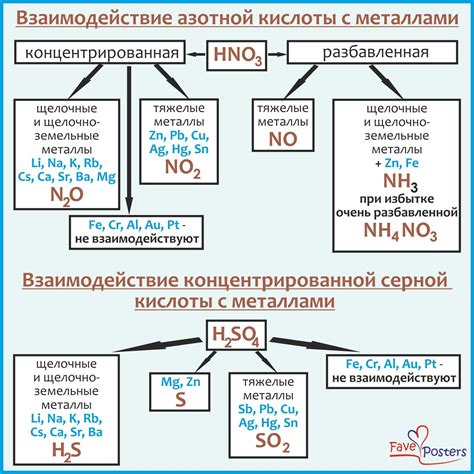
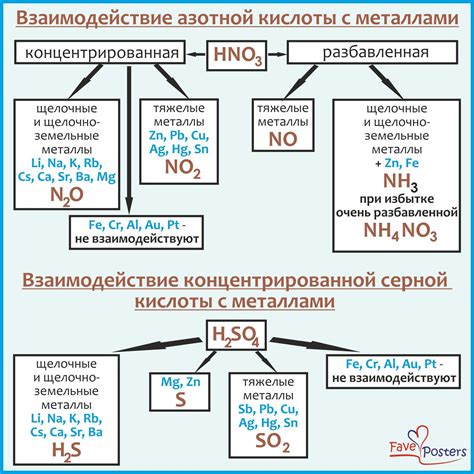
Некоторые кислоты, например, соляная кислота (HCl), реагируют с металлами, такими как цинк (Zn) и алюминий (Al), с образованием соответствующих солей и выделением водорода. В результате этой реакции величина рН раствора может снижаться, что свидетельствует о кислотном характере раствора.
Другие кислоты, такие как серная (H2SO4) и азотная (HNO3), также могут реагировать с металлами, но при этом величина рН раствора может повышаться, что свидетельствует о щелочном характере раствора. При этом образуются соответствующие соли и выделяются оксиды металлов.
Таким образом, взаимодействие кислот с металлами приводит к изменению величины рН раствора. Это зависит от природы используемой кислоты и ее способности образовывать соли с металлами. Изучение этих реакций позволяет лучше понять химические свойства металлов и применять их в различных областях науки и промышленности.
Изменение РН при образовании соляных соединений с металлами
Взаимодействие кислот с металлами приводит к образованию соляных соединений, что может влиять на изменение значения рН. При взаимодействии кислоты с металлом происходит образование соли и выделение водорода.
В большинстве случаев, когда кислота реагирует с металлом, реакция сопровождается выделением водорода. В результате происходит снижение значения рН раствора. Это связано с тем, что выделение водорода приводит к повышению его концентрации в растворе, что, в свою очередь, увеличивает концентрацию ионов Н+. Таким образом, реакция с металлом приводит к повышению кислотности раствора и снижению его значения рН.
Однако не все металлы способны взаимодействовать с кислотами с выделением водорода. Некоторые металлы, например, алюминий или железо, могут реагировать с кислотой без выделения водорода. В данном случае, реакция протекает без изменения значения рН раствора, так как не сопровождается образованием избыточных ионов Н+ или ОН-.
Уровень РН при взаимодействии кислот с различными металлами

Один из основных факторов, влияющих на изменение величины рН при взаимодействии кислот с металлами, - это природа металлического элемента. РН показатель, являющийся мерой кислотности или щелочности среды, может существенно изменяться в зависимости от использованных металлов.
Некоторые металлы, такие как цинк или железо, могут вступать в реакцию с кислотой и повышать величину рН. Это происходит из-за образования ионов металла и их реакции с водой, что увеличивает концентрацию гидроксидных ионов и, соответственно, повышает величину рН.
В то же время, некоторые другие металлы, например, алюминий или свинец, могут взаимодействовать с кислотой и снижать величину рН. Это происходит из-за распада воды и образования водорода, который снижает концентрацию гидроксидных ионов и, соответственно, снижает величину рН.
Важно отметить, что реактивность металлов и влияние на величину рН зависят не только от самого металла, но также от его концентрации и условий взаимодействия с кислотой. Различные кислоты также могут вести себя по-разному в присутствии определенных металлов, что может привести к различным изменениям величины рН.
В целом, взаимодействие кислот с металлами может приводить к значительным изменениям в величине рН. При выборе и использовании металлов в различных процессах и реакциях необходимо учитывать их влияние на уровень рН, поскольку это может оказывать важное влияние на результаты и эффективность реакций.
Практическое применение зависимости РН от природы кислот при взаимодействии с металлами
Изучение зависимости рН от природы кислот при взаимодействии с металлами имеет важное практическое значение в различных областях науки и техники.
В металлургии и химической промышленности знание этой зависимости позволяет оптимизировать процессы экстракции металлов из руд и отходов производства. При взаимодействии ионов металлов с кислотами происходит их образование комплексных соединений, которые могут быть анализированы с использованием измерения рН. Такая информация помогает контролировать и регулировать процессы, например, при извлечении полезных металлов из руд и создании новых материалов с заданными свойствами.
В медицине и фармакологии понимание зависимости рН от кислотности помогает ученым разрабатывать и оптимизировать фармацевтические препараты. При проектировании лекарственных средств учитывается их взаимодействие с физиологической средой человеческого организма, в том числе с кислотной средой желудочного сока или щелочностью крови. Такие знания позволяют улучшить биодоступность препаратов и обеспечить их эффективное действие.
Изучение зависимости рН от природы кислот при взаимодействии с металлами также применяется в экологическом мониторинге и анализе окружающей среды. Активное использование металлов в промышленности приводит к их попаданию в природные водоёмы и почву. Зависимость рН от кислотности позволяет контролировать уровень загрязнения источников воды и почвы металлами, что важно для оценки их экологической безопасности и принятия соответствующих мер по охране окружающей среды.
Выводы о важности понимания зависимости РН от природы кислот при взаимодействии с металлами
Изучение влияния кислот на окружающую среду и обмен между металлами и растворителями является важной задачей в химии. Зависимость величины pH от химической структуры кислот и их взаимодействия с металлами имеет важное значение для понимания протекающих химических процессов.
Определение величины рН позволяет оценить кислотность или щелочность взаимодействующих веществ, а также предсказать характер протекающих реакций. Знание зависимости рН от природы кислот при взаимодействии с металлами помогает оценить степень растворимости соединений и влияние окружающей среды на стабильность металлических элементов.
Кроме того, понимание зависимости рН от природы кислот при взаимодействии с металлами имеет практическое применение. Разработка новых катализаторов, а также проведение различных химических реакций требуют учета рН среды и установления оптимальных условий для достижения желаемого результата. Изучение взаимодействия металлов с кислотами позволяет разрабатывать новые методы синтеза и модификации материалов с заданными химическими и физическими свойствами.
В целом, понимание зависимости рН от природы кислот при взаимодействии с металлами играет важную роль в различных областях химии и науки в целом. Это позволяет расширить наши знания о химических процессах, повысить эффективность различных реакций и применять полученные результаты на практике для решения различных задач и проблем.
Вопрос-ответ

Влияет ли природа кислоты на значение рН при взаимодействии с металлами?
Да, природа кислоты имеет влияние на значение рН при взаимодействии с металлами. Различные кислоты могут иметь разную силу и ионизацию, что приводит к различным значениям рН.
Какие кислоты могут оказывать кислотное взаимодействие с металлами?
Различные кислоты могут оказывать кислотное взаимодействие с металлами. Например, сильные минеральные кислоты, такие как серная кислота или хлороводородная кислота, могут быстро реагировать с металлами и образовывать соли.
Может ли значение рН измениться при взаимодействии кислоты с металлом?
Да, значение рН может измениться при взаимодействии кислоты с металлом. Реакция между кислотой и металлом может привести к образованию новых соединений, которые могут изменять концентрацию ионов в растворе и, следовательно, значение рН.
Как металлы воздействуют на рН раствора кислоты?
Металлы могут воздействовать на рН раствора кислоты путем реакции с ионами водорода. Например, если металл способен выделять ионы водорода из кислоты, то это может привести к повышению концентрации ионов водорода и, соответственно, повышению рН раствора.
Почему для исследования взаимодействия кислот с металлами удобно использовать значение рН?
Для исследования взаимодействия кислот с металлами удобно использовать значение рН, потому что оно является мерой кислотности или щелочности раствора. Зная значения рН до и после взаимодействия, можно определить, произошло ли изменение концентрации ионов водорода и, следовательно, понять, какое влияние оказал металл на кислотность раствора.
