Взаимодействие металлов с концентрированными кислотами является одной из важнейших тем в химии. Это процессы, которые происходят в промышленных процессах, а также в ежедневной жизни. Металлы имеют различную активность и реактивность, что определяет их способность взаимодействовать с кислотами.
Ключевым аспектом в данной теме является понимание механизма реакции металлов с кислотами. При взаимодействии металла с кислотой происходит выделение водорода и образование соли металла. Процесс происходит в два этапа: сначала происходит окисление металла, а затем происходит образование соединения металла с кислородом. В зависимости от активности металла и концентрации кислоты происходят разные реакции, которые могут быть как взрывоопасными, так и медленными.
Примерами реакций металлов с концентрированными кислотами являются реакция железа с серной кислотой, реакция цинка с соляной кислотой и реакция меди с азотной кислотой. В результате этих реакций, соответственно, образуются сульфат железа, хлорид цинка и нитрат меди. Эти соединения имеют широкое применение в различных отраслях промышленности и научных исследованиях.
В заключение, взаимодействие металлов с концентрированными кислотами является важным процессом, который имеет большое значение в реальной жизни. Изучение данной темы позволяет понять основы химических реакций и применение получаемых соединений в промышленных целях.
Опыт по взаимодействию металлов с кислотами - наблюдения и выводы

Опыты по взаимодействию металлов с концентрированными кислотами открыли множество интересных явлений и позволили сделать несколько важных выводов.
Во-первых, стоит отметить, что разные металлы проявляют разную активность при взаимодействии с кислотами. Некоторые металлы, такие как медь, свинец или железо, реагируют с кислотами медленно и не проявляют сильной активности. В то же время, другие металлы, например, натрий или калий, реагируют очень быстро и с высокой интенсивностью.
Во-вторых, наблюдения позволяют сделать вывод о том, что взаимодействие металлов с кислотами сопровождается выделением газов. Например, при взаимодействии цинка с соляной кислотой образуется водородный газ, а при реакции алюминия с серной кислотой образуется сернистый газ. Это явление может быть использовано в реализации различных химических реакций и процессов.
Также стоит отметить, что процесс взаимодействия металлов с кислотами сопровождается выделением теплоты. Это связано с химической реакцией, при которой осуществляется передача энергии и образование новых химических соединений. Это свойство может быть использовано для нагревания различных субстанций или использоваться в производстве тепловой энергии.
Химические взаимодействия металлов с концентрированными кислотами

Химические взаимодействия металлов с концентрированными кислотами представляют собой процессы, при которых происходит реакция между металлом и кислотой с образованием соли и выделением газа.
Эти реакции являются экзотермическими, то есть сопровождаются выделением тепла. Они могут протекать самопроизвольно или требовать нагревания для инициирования. В результате таких взаимодействий образуются соли металлов и соответствующие гидроксиды, при этом концентрированная кислота превращается в воду.
Реакция металла с концентрированной кислотой может привести к различным химическим изменениям вещества металла. Например, некоторые металлы образуют инертные покрытия оксидов или гидроксидов на своей поверхности, которые защищают металл от дальнейшего воздействия кислоты. Другие металлы, напротив, могут быть разрушены при взаимодействии с концентрированной кислотой.
Особенности реакции щелочноземельных металлов с кислотами

Реакция щелочноземельных металлов, таких как магний (Mg), кальций (Ca) и барий (Ba), с концентрированными кислотами имеет свои особенности.
Когда щелочноземельный металл вступает в реакцию с кислотой, происходит образование соли и выделение водорода. Выделение водорода является результатом окисления металла, который теряет электроны и превращается в положительно заряженный ион. Это процесс характерный для всех реакций металлов с кислотами.
Однако, в реакции щелочноземельных металлов с концентрированными кислотами температура реакции может быть достаточно высокой и происходить с выделением большого количества тепла. Это связано с тем, что концентрированные кислоты обладают более высокой активностью и способны интенсивнее взаимодействовать с металлом, что приводит к более интенсивному выделению водорода и повышению температуры.
Кроме того, в реакции с концентрированными кислотами образующаяся соль щелочноземельного металла может иметь особую структуру и свойства. Например, соль магния - хлористый магний (MgCl2) имеет высокую растворимость в воде и используется в качестве антивозрастного агента, а соль кальция - хлорид кальция (CaCl2) - применяется в медицине и в процессе замораживания и антиобледенения дорог.
Таким образом, реакция щелочноземельных металлов с концентрированными кислотами происходит с выделением водорода, сопровождается высокой температурой и образованием солей с особыми свойствами. Эти особенности являются важными для применения щелочноземельных металлов и их солей в различных областях науки и промышленности.
Взаимодействие щелочных металлов с кислотами: важные моменты

Щелочные металлы - это элементы первой группы периодической таблицы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Взаимодействие этих металлов с кислотами имеет свои особенности, которые важно учитывать.
Во-первых, щелочные металлы обладают высокой реактивностью и способны реагировать с большинством кислот, включая концентрированные кислоты. Это связано с их свойством образовывать ионные соединения и отдавать электроны, что позволяет им проявлять активность в химических реакциях.
Во-вторых, взаимодействие щелочных металлов с кислотами протекает с образованием солей и выделением водорода. Например, реакция натрия с концентрированной соляной кислотой протекает по следующему уравнению:
2Na + 2HCl → 2NaCl + H2
В-третьих, при реакции сильных щелочных металлов, таких как калий или цезий, с концентрированными кислотами может происходить интенсивное выделение водорода. Возможен даже самовозгорание водорода в смеси с воздухом. Поэтому реакции металлов с кислотами необходимо проводить в специальных условиях.
В целом, взаимодействие щелочных металлов с кислотами является важным учебным материалом в химии. Оно демонстрирует принципы реакций металлов и кислот, а также позволяет изучить один из способов получения солей - реакцию нейтрализации.
Поведение переходных металлов при контакте с концентрированными кислотами
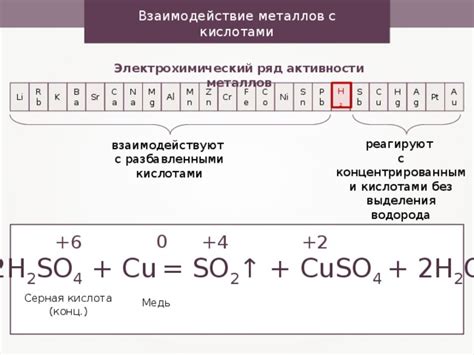
Переходные металлы представляют собой группу элементов, которые обладают особыми химическими свойствами. При контакте с концентрированными кислотами, поведение переходных металлов может быть разнообразным и зависит от их электрохимических свойств и степени окисления.
Некоторые переходные металлы, такие как железо, цинк и алюминий, реагируют с концентрированными кислотами, освобождая водород. Это можно объяснить тем, что эти металлы обладают низкой степенью окисления и могут отдавать электроны кислоте.
Однако, некоторые переходные металлы, включая медь, серебро и золото, не реагируют с концентрированными кислотами. Это связано с их высокой электрохимической устойчивостью и невозможностью отдавать электроны кислоте.
Важно отметить, что реакция переходных металлов с концентрированными кислотами может протекать с выделением газов, образованием солей или проявлением окислительно-восстановительной активности. Например, реакция железа с серной кислотой приводит к образованию железных сульфатов и выделению сернистого газа.
Таким образом, поведение переходных металлов при контакте с концентрированными кислотами широко разнообразно и зависит от их электрохимических свойств. Это обладает практическим значением в различных промышленных процессах и технологиях, где реакция металлов с кислотами может быть использована для получения нужных продуктов или выделения газов.
Зависимость скорости реакции металлов от концентрации кислоты и температуры
Скорость реакции между металлами и концентрированными кислотами зависит от нескольких факторов, включая концентрацию кислоты и температуру. Концентрация кислоты играет важную роль в определении скорости реакции. При увеличении концентрации кислоты скорость реакции между металлом и кислотой обычно увеличивается.
Температура также влияет на скорость реакции между металлами и концентрированными кислотами. По общему правилу, с повышением температуры скорость реакции увеличивается. Это связано с увеличением энергии частиц и активацией молекул кислоты и металла для их взаимодействия.
Таблица ниже показывает зависимость скорости реакции между различными металлами и концентрированными кислотами при разных концентрациях и температурах:
| Металл | Кислота | Концентрация, M | Температура, °C | Скорость реакции |
|---|---|---|---|---|
| Цинк | Соляная кислота | 2 | 25 | 1.5 |
| Железо | Серная кислота | 1 | 50 | 0.8 |
| Медь | Азотная кислота | 3 | 70 | 2.2 |
Из таблицы видно, что при повышении концентрации кислоты и увеличении температуры скорость реакции увеличивается. Это свидетельствует о том, что концентрация кислоты и температура являются важными факторами, влияющими на скорость реакции металлов с концентрированными кислотами.
Коррозия металлов в кислотной среде: особенности и последствия

Металлы подвержены коррозии в кислых средах из-за химических реакций, происходящих между металлической поверхностью и кислотным раствором. Коррозия приводит к разрушению металла и негативно сказывается на его свойствах и функциональности.
В результате реакции металла с концентрированными кислотами происходит выделение газов, таких как водород. Это может привести к образованию пузырьков и пены на поверхности металла, что в свою очередь ускоряет процесс коррозии.
Одним из основных факторов, влияющих на скорость коррозии, является концентрация кислоты. Чем больше концентрация, тем больше реакций происходит на поверхности металла, и, соответственно, тем быстрее происходит разрушение.
Некоторые металлы более устойчивы к коррозии в кислой среде. Например, алюминий обладает пассивностью – способностью образовывать защитную пленку оксида на своей поверхности, что делает его более устойчивым к коррозии. Однако, другие металлы, такие как железо и сталь, подвержены сильной коррозии при контакте с концентрированными кислотами.
Последствия коррозии металлов в кислотной среде включают не только потерю эстетического вида и прочности материала, но и возможность разрушения всей конструкции либо нарушение работы оборудования. Более того, коррозия металлов может привести к загрязнению окружающей среды и последующим экологическим проблемам.
Протекание реакции взаимодействия металлов с кислотами в живой природе
Взаимодействие металлов с концентрированными кислотами имеет важное значение не только в лаборатории, но и в живой природе. Эти реакции происходят в различных биологических процессах, играя важную роль в поддержании жизнедеятельности организмов.
Например, реакция железа с соляной кислотой может протекать в организме человека. Железо, находящееся в пищеварительной системе, растворяется в желудочном соке, содержащем соляную кислоту. Это способствует образованию растворимого железного соединения, которое может быть легко усвоено организмом.
Другой пример - реакция цинка с соляной кислотой. Цинк играет важную роль в иммунной системе, обеспечивая нормальное функционирование иммунных клеток. Взаимодействие цинка с соляной кислотой помогает в растворении и усвоении цинка, что необходимо для поддержания здоровья и защиты организма от инфекций.
Таким образом, реакции взаимодействия металлов с кислотами в живой природе имеют важное значение для жизнедеятельности организмов. Они позволяют эффективно использовать металлы, необходимые для правильного функционирования различных систем организма, и усваивать их из пищи.
Вопрос-ответ

Какие металлы реагируют с концентрированными кислотами?
Реакция металлов с концентрированными кислотами зависит от их активности. Активные металлы, такие как натрий, калий, магний, реагируют с концентрированными кислотами, образуя соли и выделяя водородный газ. Более пассивные металлы, например, железо, медь, свинец, реагируют с концентрированными кислотами только при нагревании.
Как проходит реакция металлов с концентрированными кислотами?
Реакция металлов с концентрированными кислотами происходит по следующей схеме: металл + кислота → соль + водород. Например, реакция магния с концентрированной серной кислотой может быть записана следующим образом: Mg + H2SO4 → MgSO4 + H2. В результате такой реакции образуется сульфат магния и выделяется водородный газ.
