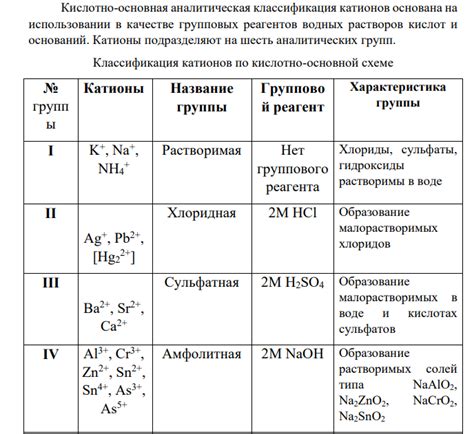
Кислоты являются одной из важнейших групп химических соединений, широко используемых в различных отраслях промышленности и научных исследованиях. Они играют роль как в органической, так и в неорганической химии. Кислоты характеризуются определенными свойствами, связанными с наличием в их составе водородных и металлических катионов.
Вода является одной из важнейших природных кислот, в которой водородные катионы (H+) играют значительную роль. Они определяют кислотность раствора и его pH-значение. Водородные катионы обладают высокой активностью и могут выполнять функцию донора протона. Они образуют связь с отрицательно заряженными кислородными или азотными атомами других молекул или ионов. Большинство кислот образуются в результате протекания химических реакций, в которых вода выступает в качестве реагента или продукта.
Кроме водородных катионов, некоторые кислоты содержат в своем составе металлические катионы, такие как натрий (Na+), калий (K+), кальций (Ca2+), магний (Mg2+) и другие. Металлические катионы придают кислотам определенные свойства и способствуют их растворимости в воде. Они также могут быть использованы в качестве катализаторов в химических реакциях. Металлические катионы обеспечивают стабильность и сохранение свойств кислоты при различных условиях и взаимодействиях с другими веществами.
Роль водородных и металлических катионов в свойствах кислот
Водородные и металлические катионы играют важную роль в свойствах кислот. Водородный катион (H+) является основным составляющим кислоты и определяет ее кислотность. Катион образуется при диссоциации кислоты в водном растворе. Водородные катионы обладают положительным зарядом и могут образовывать связи с отрицательно заряженными ионами или частицами.
Водородные катионы определяют силу кислоты. Чем больше водородных катионов образуется при диссоциации кислоты, тем большая концентрация водородных ионов в растворе и тем сильнее кислота. Сильные кислоты, такие как серная или солянка, полностью диссоциируют в воде, образуя большое количество водородных катионов. В то время как слабые кислоты, такие как уксусная или соляная кислота, диссоциируются только частично, образуя меньшее количество водородных катионов.
Металлические катионы также влияют на свойства кислот. Металлы, такие как натрий, калий или кальций, могут образовывать кислотные соли с кислотами. Эти металлические катионы способны стабилизировать кислоту, снижая ее активность. Кроме того, металлические катионы могут формировать комплексы с кислотами, что влияет на их растворимость и активность.
В целом, водородные и металлические катионы играют важную роль в свойствах кислот. Они определяют кислотность кислоты и влияют на ее силу. Металлические катионы также могут влиять на стабильность кислот и их растворимость. Изучение роли этих катионов позволяет лучше понять химические свойства кислот и их взаимодействия с другими веществами.
Кислоты и их классификация
Кислоты - это химические вещества, которые обладают кислотными свойствами, проявляющимися в ионизации в воде и образовании положительных водородных ионов (H+). Они являются одним из основных классов химических соединений.
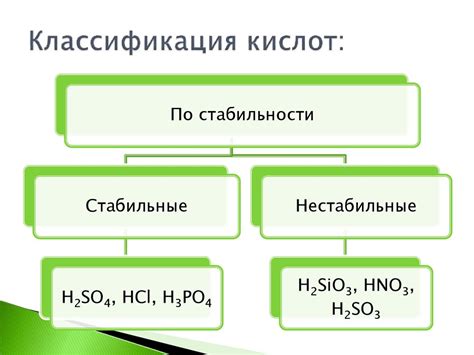
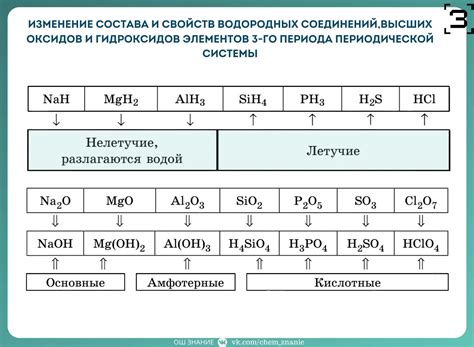
Классификация кислот может быть основана на различных принципах, таких как их исходные вещества, степень ионизации или химическая структура. Одним из наиболее распространенных способов классификации кислот является разделение их на неорганические и органические кислоты.
Неорганические кислоты обычно получают из неорганических соединений, таких как minerales, оксиды или галогены. Они включают такие кислоты, как серная кислота (H2SO4), соляная кислота (HCl) и азотная кислота (HNO3). Неорганические кислоты обычно химически активны и широко используются в промышленности и научных исследованиях.
Органические кислоты, в свою очередь, получают из органических соединений, таких как углеводороды. Они играют важную роль в биологических процессах и обладают определенными химическими свойствами. Классификация органических кислот основана на химической структуре и включает, например, уксусную кислоту (CH3COOH), лимонную кислоту (C6H8O7) и молочную кислоту (C3H6O3).
Также кислоты могут быть классифицированы по степени ионизации. Сильные кислоты (например, HCl) полностью ионизируются в воде, образуя H+ и соответствующие отрицательные ионы. Слабые кислоты (например, уксусная кислота) частично ионизируются и имеют меньшую активность.
Конечно, существует множество других подходов к классификации кислот, учитывающих разные аспекты их свойств и применения. Независимо от классификации, кислоты являются важными соединениями в химической и биологической науке и имеют широкий спектр применений в промышленности и повседневной жизни.
Свойства кислотных растворов
Кислотные растворы обладают рядом свойств, которые определяются присутствием ионов водорода (H+) и металлических катионов. Эти свойства включают кислотность, электропроводность, реакцию с щелочами, солевую образование и окислительно-восстановительные свойства.
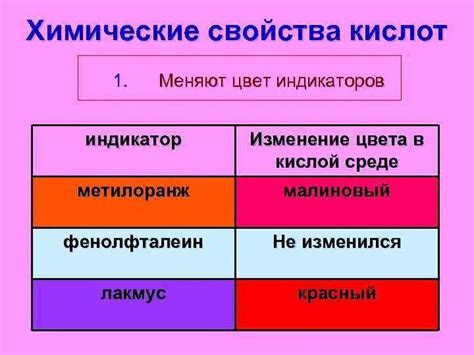
Кислотность является основным свойством кислотных растворов. Кислотные растворы изменяют цвет фенолфталеина при переходе из розового в безцветный, а также имеют кислый вкус и способны разъедать металлы.
Электропроводность кислотных растворов объясняется наличием ионов H+ и катионов металлов. Они создают механизм передачи электрического тока через раствор, что делает их полностью ионизированными.
Кислотные растворы реагируют с щелочами, образуя соли и воду в процессе нейтрализации. В результате этой реакции степень кислотности раствора уменьшается, а его pH становится ближе к нейтральному значению 7.
Некоторые кислотные растворы обладают окислительно-восстановительными свойствами, что означает, что они могут принимать участие в химических реакциях, включающих передачу электронов. Они могут окислять вещества, в результате чего сама кислота восстанавливается.
В целом, свойства кислотных растворов обусловлены химическими реакциями, происходящими между ионами водорода и металлическими катионами, что делает их важными для множества различных процессов в природе и промышленности.
Роль водородных катионов в кислотных растворах
Водородные катионы играют важную роль в кислотных растворах. Когда кислота растворяется в воде, она диссоциирует, образуя водородные катионы (H+) и анионы. Водородные катионы являются основными ионами, отвечающими за кислотность раствора.
На самом деле, водородные катионы в кислотных растворах являются подвижными и достаточно реактивными. Они образуют химические связи с другими ионами или молекулами, образуя различные соединения. Эти реакции могут быть как обратимыми, так и необратимыми, в зависимости от условий.
Водородные катионы также играют важную роль при проведении различных химических реакций в кислотных средах. Они могут действовать как катализаторы, ускоряя химические реакции. Кроме того, водородные катионы могут принимать участие в процессах окисления и восстановления, изменяя оксидационные состояния других веществ.
И, наконец, водородные катионы обладают большой важностью в биологических системах, так как они являются частью многих веществ, необходимых для жизнедеятельности организмов. Они участвуют в обмене веществ, регулировании рН, передаче нервных импульсов и многих других процессах, необходимых для поддержания жизни.
Различия металлических катионов в кислотах
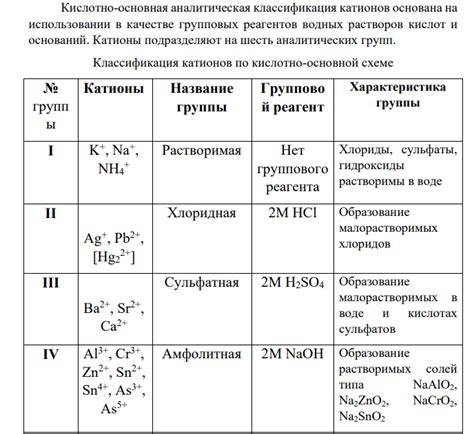
Металлические катионы исполняют важную роль в реакциях кислот. Катионы различаются по своей химической активности и способности образовывать стабильные соединения с анионами. Они также влияют на кислотность растворов и свойства получаемых кислотных соединений.
Первое различие заключается в влиянии металлических катионов на степень ионизации кислоты. Некоторые катионы образуют более стабильные соединения с анионами, что приводит к более низкой степени ионизации кислоты. Это может быть обусловлено различием в электронной структуре катионов и их электроотрицательностью. Таким образом, разные металлические катионы могут обусловливать различную силу и кислотность растворов.
Второе различие металлических катионов в кислотах связано с их способностью образовывать комплексные соединения. Некоторые катионы, такие как железо или медь, обладают способностью образовывать комплексы с анионами и нейтральными молекулами. Это приводит к образованию стабильных соединений с более сложной структурой и изменению кислотности раствора. Кроме того, комплексные соединения могут иметь различные физические и химические свойства, что также влияет на свойства кислоты, в которой присутствует данный металлический катион.
Третье различие металлических катионов в кислотах связано с их способностью взаимодействовать с другими веществами. Некоторые катионы образуют стабильные соединения с определенными анионами или нейтральными молекулами, что может приводить к образованию осадков или изменению физических свойств растворов. Кроме того, реакция металлических катионов с кислотами может влиять на скорость реакции и образование продуктов.
Таким образом, металлические катионы в кислотах играют важную роль в их свойствах и реакциях. Различия в свойствах металлических катионов могут приводить к различиям в кислотности растворов и образованию стабильных соединений. Это важно учитывать при изучении и применении кислотных соединений.
Влияние водородных катионов на кислотность
Водородные катионы играют важную роль в определении кислотности растворов. Кислотность определяется концентрацией водородных катионов в растворе. Чем больше водородных катионов присутствует в растворе, тем кислее он будет. Вода, например, содержит равное количество водородных и гидроксильных ионов, поэтому ее рН равен 7, что говорит о ее нейтральности.
При добавлении кислотных веществ в воду, они диссоциируются на ионы, в том числе и на водородные катионы. В результате концентрация водородных катионов в растворе увеличивается, что делает раствор кислотнее. Например, соляная кислота, которая диссоциирует на ионы водорода и хлорида, является сильной кислотой и имеет низкий показатель рН.
Водородные катионы также могут влиять на свойства веществ, например, на их растворимость. Большинство веществ, растворимых в воде, могут образовывать водородные связи с водой, что способствует их растворению. Это свойство воды объясняет ее способность растворять множество веществ и играет важную роль в химических реакциях.
Значение металлических катионов в химических реакциях кислот

Металлические катионы играют важную роль в химических реакциях кислот, определяя их свойства и химическую активность.
Кислоты, содержащие металлические катионы, обладают рядом особенностей, которые обусловлены взаимодействием катионов с другими веществами. Например, металлические катионы выполняют роль активных центров катализаторов во многих химических реакциях. Их присутствие может значительно ускорить реакцию и повысить ее эффективность.
Также металлические катионы способны образовывать комплексные соединения с кислотами, что придает им уникальные свойства. Например, образование комплексов между металлическими катионами и кислотами может улучшить их растворимость и стабильность. Это может быть особенно важно в фармацевтической и химической промышленности, где кислоты и их комплексы широко используются в процессах синтеза и производства.
Еще одной важной функцией металлических катионов в химических реакциях кислот является их способность образовывать соли. Металлические соли кислот обладают отличными физическими и химическими свойствами, что делает их полезными для различных применений. Например, некоторые металлические соли кислот используются в производстве удобрений, красителей, лаков и многих других продуктов.
Кроме того, металлические катионы могут влиять на окраску и степень окисления кислот. Некоторые металлические катионы могут иметь разную степень окисления, что влияет на их электрохимические свойства. Это позволяет использовать кислоты с металлическими катионами в электрохимических процессах, таких как гальваническое покрытие металлами и аккумуляторные батареи.
Вопрос-ответ

Какие свойства у кислот?
Кислоты обладают рядом общих свойств, таких как кислотные вкус и реакция с металлами, основаниями и водой. Они могут быть раздражающими для кожи и слизистых оболочек.
Что такое водородные катионы и какова их роль в кислотах?
Водородные катионы - это положительно заряженные атомы водорода. Они играют ключевую роль в кислотных реакциях, так как передаются от кислоты к другому веществу, которое принимает водород, называемому основанием.
Какие металлические катионы могут взаимодействовать с кислотами?
Металлические катионы, такие как ионы натрия (Na+), калия (K+), магния (Mg2+), цинка (Zn2+), железа (Fe3+) и другие, могут взаимодействовать с кислотами. Они могут образовывать с ними соли или просто растворяться в кислотном растворе.
В чем заключается роль водородных и металлических катионов в образовании солей?
Водородные и металлические катионы играют решающую роль в образовании солей. Когда кислоты реагируют с щелочами или основаниями, водородные катионы передаются основанию, а металлические катионы образуют соли с анионами основания.
