Металлы - это класс элементов, обладающих такими основными химическими свойствами, как тепло- и электропроводность, блеск, пластичность и металлический вид. Однако, не все металлы обладают одинаковыми свойствами, и отдельные металлы могут иметь различные свойства в зависимости от ряда факторов.
Первый и один из самых важных факторов, который влияет на химические свойства металлов, это их атомная структура. Металлы обладают кристаллической решеткой, состоящей из атомов, и их свойства напрямую связаны с этой структурой. Например, форма и размеры решетки определяют плотность металла, а расстояние между атомами влияет на его электропроводность. Также, атомная структура определяет способность металлов к образованию ионов и связей с другими элементами.
Второй фактор, влияющий на химические свойства металлов, это валентность. Валентность - это число внешних электронов атома металла, которое определяет его способность образовывать связи с другими элементами. Чем больше валентность металла, тем больше связей может он образовывать, а значит, больше разнообразных соединений может образовать. Например, металлы с валентностью 1 образуют простые ионы, а металлы с валентностью 2 образуют двойные ионы или соединения с другими металлами.
Еще одним фактором, влияющим на химические свойства металлов, является их положение в периодической системе элементов. Металлы, находящиеся на левой стороне периодической системы, обычно обладают большей реакционной способностью и могут образовывать более широкий спектр соединений. Металлы, находящиеся в правой части периодической системы, обычно менее реакционны и могут образовывать только определенные типы соединений.
Факторы, влияющие на химические свойства металлов

Химические свойства металлов определяются рядом факторов, которые влияют на их реакционную способность и способность образовывать соединения. Основные факторы, которые определяют химические свойства металлов, включают:
- Электроотрицательность: это способность атома притягивать электроны. Металлы с низкой электроотрицательностью обычно имеют большую склонность отдавать электроны и образовывать положительно заряженные ионы.
- Размер атома: размер атома металла также влияет на его реакционную способность. Чем меньше атом, тем больше его электроны сосредоточены на внешнем энергетическом уровне, что делает их легче отдаваемыми.
- Степень окисления: степень окисления металла описывает, сколько электронов металл отдал или принял при образовании ионов. Эта характеристика влияет на его реакционную способность и способность образовывать различные соединения.
- Кристаллическая структура: кристаллическая структура металла также влияет на его химические свойства. Например, кубическая решетка типична для многих металлов и обеспечивает устойчивость и прочность материала.
- Энергия ионизации: энергия ионизации отражает энергию, необходимую для удаления электрона из атома металла. Более низкая энергия ионизации свидетельствует о большей реакционноспособности металла и его способности образовывать положительные ионы.
- Частота деградации: металлы могут подвергаться различным видам химической коррозии, что влияет на их химические свойства, включая скорость окисления и возможность образовывать стойкие окислительные пленки на поверхности.
Все эти факторы взаимосвязаны и определяют химические свойства металлов. Понимание этих факторов позволяет улучшить применение металлов в различных отраслях промышленности и научных исследованиях.
Ионные радиусы и заряд
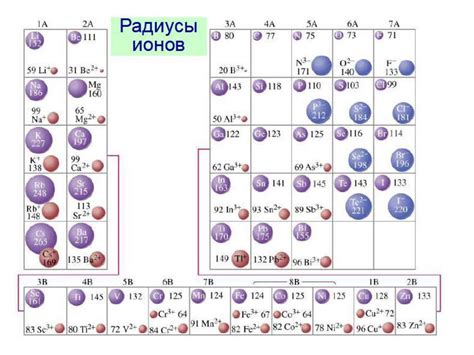
Ионные радиусы и заряд являются важными факторами, определяющими химические свойства металлов. Ионный радиус - это расстояние от центра иона до его внешней электронной оболочки. Заряд иона - это количество электронов, которые он потерял или получил.
Металлы, образующие положительные ионы (катионы), имеют тенденцию терять электроны и образовывать катионы с положительным зарядом. Чем больше заряд катиона, тем меньше его ионный радиус. Это объясняется тем, что при потере электронов электронные оболочки сжимаются, создавая более сильное притяжение ядра к оставшимся электронам.
Ионный радиус также зависит от конфигурации электронной оболочки. Лантаноиды и актиноиды, расположенные в периодической системе под главной таблицей, имеют пониженные ионные радиусы из-за заполнения 4f- и 5f-орбиталей, предоставляющих электронную защиту для внешних s- и d-орбиталей.
Размер ионов металлов также может изменяться в зависимости от окружающих ионов или молекул. Например, при двойственности зарядов анионов и катионов происходит явление сжатия или растяжения ионной решетки. Это может сказаться на химических свойствах металлов, таких как растворимость или реакционная способность.
Важно отметить, что на химические свойства металлов также влияет электроотрицательность ионообразующего элемента. Чем выше электроотрицательность элемента, образующего ион, тем меньше его ионный радиус и тем меньше склонность к образованию катионов.
Электроотрицательность элемента
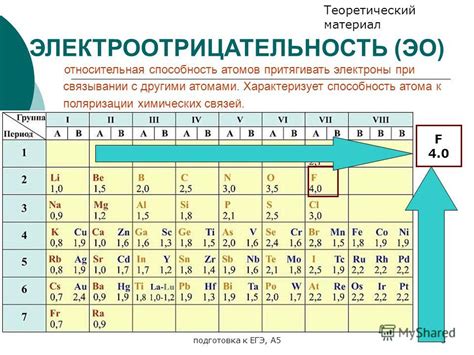
Электроотрицательность элемента является одним из факторов, определяющих его химические свойства. Электроотрицательность характеризует способность атома притягивать к себе электроны в химической связи. Чем выше электроотрицательность элемента, тем сильнее он притягивает электроны.
Электроотрицательность элемента влияет на его способность образовывать ионные и ковалентные связи. Элементы с высокой электроотрицательностью, такие как кислород и хлор, обладают большой способностью притягивать электроны и образовывать ковалентные связи. Напротив, элементы с низкой электроотрицательностью, такие как натрий и магний, имеют меньшую способность притягивать электроны и более предпочитают образовывать ионные связи.
Электроотрицательность также может влиять на реакционную активность элемента. Элементы с высокой электроотрицательностью образуют легко ионные и ковалентные связи и имеют большую склонность к химическим реакциям. Напротив, элементы с низкой электроотрицательностью обладают меньшими возможностями для образования связей и обычно проявляют меньшую активность в химических реакциях.
Таблица Менделеева и система периодического указания электроотрицательности позволяют проводить сравнительный анализ химических свойств элементов и прогнозировать возможные реакции. Знание электроотрицательности элементов является важным для понимания и объяснения различных химических явлений, таких как образование солей, кислот и оснований, окислительно-восстановительные реакции и многое другое.
Степень окисления
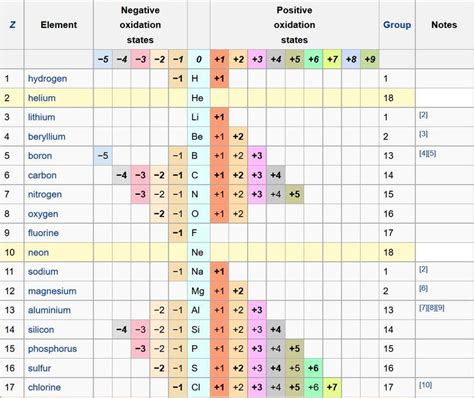
Степень окисления является одним из важных химических свойств металлов. Она определяет количество электронов, которые металл может отдать или принять при образовании химических соединений.
Степень окисления зависит от положения металла в периодической системе и его электроотрицательности. Более электроотрицательные металлы имеют склонность отдавать электроны и образовывать ионы положительной заряды, то есть имеют положительную степень окисления. Например, натрий имеет степень окисления +1.
Меньше электроотрицательные металлы имеют склонность принимать электроны и образовывать ионы отрицательной заряды, то есть имеют отрицательную степень окисления. Например, железо имеет степень окисления +3.
Степень окисления металла может быть одной и той же при образовании различных соединений, но также может меняться в зависимости от условий реакции. Например, железо может иметь степень окисления +2 в одних соединениях и +3 в других.
Знание степени окисления металла позволяет определить его химическую активность и предсказать его возможные реакции с другими веществами. Это важно для понимания реакций окисления-восстановления и формирования соединений металлов с неметаллами.
Степень гидридообразования
Степень гидридообразования является одним из важных химических свойств металлов. Гидриды металлов – это соединения, в которых металл образует химическую связь с водородом.
Способность металла образовывать гидриды определяется его электрохимической активностью и электроотрицательностью. Чем выше активность металла, тем больше вероятность его взаимодействия с водородом и образования гидрида.
Степень гидридообразования также зависит от условий окружающей среды. При повышенной температуре и давлении металлы могут образовывать гидриды более активно. Некоторые металлы, например, литий и натрий, могут образовывать гидриды даже при обычных условиях.
Свойства гидридов металлов могут быть различными. Некоторые гидриды являются стабильными и обладают высокой теплостойкостью, другие могут быть нестабильными и более реактивными. Эти свойства могут использоваться в различных областях промышленности и науки, включая хранение и перенос водорода.
Теплоемкость и проводимость
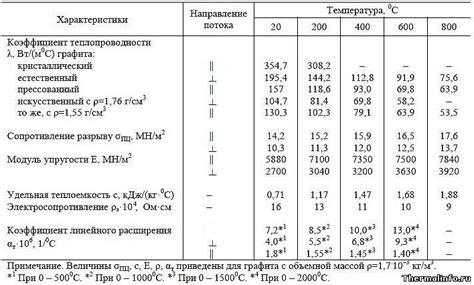
Теплоемкость — это величина, характеризующая способность вещества поглощать и отдавать тепло. У металлов теплоемкость обычно высока, что обусловлено большим числом свободных электронов в их структуре. Эти электроны хорошо проводят тепло и являются основной причиной высокой теплоемкости металлов.
Проводимость тепла является одной из важных химических характеристик металлов. Металлы обладают высокой проводимостью тепла, что позволяет им эффективно распространять тепло. Это свойство металлов объясняется наличием свободных электронов, которые легко передают энергию при возникновении разности температур.
Высокая теплоемкость и проводимость делают металлы важными материалами для производства различных устройств и механизмов. В электрической инженерии металлические проводники используются для передачи электрической энергии, а в теплотехнике металлы применяются для эффективного распределения и передачи тепла.
Таким образом, теплоемкость и проводимость являются важными химическими свойствами металлов, которые обусловлены наличием свободных электронов в их структуре. Эти свойства делают металлы ценными материалами для множества технических и промышленных приложений.
Твердотельная структура
Химические свойства металлов, включая их степень реактивности, определяются их твердотельной структурой. В общем случае металлы имеют кристаллическую структуру, в которой атомы металла регулярно упорядочены и образуют кристаллическую решетку. Такая твердотельная структура обеспечивает металлам их основные характерные свойства, такие как высокая теплопроводность, электропроводность и пластичность.
В твердом состоянии атомы металла воспринимаются как положительно заряженные ионы ядер, окруженные облаками свободных электронов. Эти свободные электроны несут отрицательный заряд и могут легко перемещаться по решетке металла. Это обеспечивает металлам их высокую электропроводность, поскольку свободные электроны могут перемещаться, создавая электрический ток.
Кроме того, твердотельная структура металлов также обуславливает их высокую теплопроводность. Свободные электроны в металлах могут свободно передавать энергию от одного атома к другому, обеспечивая передачу тепла через вещество.
Влияние твердотельной структуры на другие химические свойства металлов менее очевидно. Однако, различные атомные радиусы и заряды ионов, а также способы упаковки атомов в кристаллической решетке, могут в значительной степени влиять на их химическую активность и реакционную способность. Например, металлы с более большими ионными радиусами могут иметь более слабую силу притяжения к электронам, что делает их более реакционноспособными.
Взаимодействие с кислотами и основаниями

Металлы могут вступать во взаимодействие с кислотами и основаниями. Однако, этот процесс зависит от ряда факторов, таких как электроотрицательность элемента, его ионный радиус, а также тип веществ, с которыми происходит реакция.
Взаимодействие металлов с кислотами основано на образовании солей и выделении водорода. Кислота передает свой протон металлу, образуя соответствующую соль. Например, реакция цинка с соляной кислотой приводит к образованию хлорида цинка и выделению водорода:
Zn + 2HCl → ZnCl2 + H2
Взаимодействие металлов с основаниями приводит к образованию солей и выделению воды. Основание отдает гидроксидный ион металлу, образуя таким образом соль. Например, реакция натрия с гидроксидом натрия приводит к образованию гидроксида натрия и выделению воды:
2Na + 2NaOH → 2NaOH + H2O
Важно отметить, что не все металлы взаимодействуют с кислотами и основаниями одинаково интенсивно. Некоторые металлы могут вступать в реакцию и с кислотами, и с основаниями, тогда как другие металлы могут быть менее активными и взаимодействовать только с определенными веществами.
Активность металла в химических реакциях

Активность металлов в химических реакциях зависит от их способности образовывать ионные соединения и относиться к электроположительным элементам. Она определяется степенью их химической активности, которая влияет на их реакционную способность и способность вступать в химические соединения с другими элементами.
Наиболее активные металлы находятся в левой части периодической таблицы, такие как литий, натрий, калий, рубидий и цезий. Они легко образуют ионы положительного заряда, отдавая электроны. Это связано с тем, что у них слабая связь между электронами и ядром, что обусловлено большим радиусом атома.
Другие металлы, такие как магний, цинк, железо и алюминий, также активны, но меньше, чем алкалийные металлы. Они образуют ионы положительного заряда, но не так легко, как алкалийные металлы. Это связано с более сильной связью между электронами и ядром, что обусловлено меньшим радиусом атома.
Наиболее низкую активность обычно проявляют металлы драгоценные металлы, такие как золото, серебро и платина, а также металлы группы железа, такие как никель, кобальт и марганец. У них сильная связь между электронами и ядром, что обусловлено их малым радиусом атома, и они проявляют меньшую склонность образовывать ионы положительного заряда.
Вопрос-ответ

От каких факторов зависят химические свойства металлов?
Химические свойства металлов зависят от нескольких факторов. Основными из них являются строение атомов металла, количество электронов во внешней оболочке, а также электроотрицательность металла. Также влияние на химические свойства металлов оказывают физические характеристики, такие как плотность, температура плавления и кристаллическая структура.
Почему у разных металлов разные химические свойства?
У разных металлов разные химические свойства из-за различий в их строении атомов и количестве электронов во внешней оболочке. Число электронов во внешней оболочке определяет химическую активность металла. Кроме того, другие факторы, такие как электроотрицательность и физические свойства металлов, также влияют на их химические свойства.
Какую роль в химических свойствах металлов играют их физические характеристики?
Физические характеристики металлов, такие как плотность, температура плавления и кристаллическая структура, играют важную роль в их химических свойствах. Например, плотность металлов может влиять на их реакционную способность и растворимость в различных реагентах. Температура плавления указывает на термическую стабильность металлов и может определять их способность быть использованными в различных процессах. Кристаллическая структура металлов также может влиять на их химические свойства, так как она определяет их механическую прочность и способность принимать участие в различных реакциях.
