Взаимодействие электролита с металлом – это процесс, при котором ионы электролита, находящиеся в растворе, взаимодействуют с поверхностью металла. Это взаимодействие осуществляется путем передачи электрически заряженных частиц через раствор и между поверхностью металла и ионами электролита.
Основные механизмы взаимодействия электролита с металлом включают адсорбцию, диссоциацию и реакцию между ионами электролита и атомами металла. Во время адсорбции ионы электролита присоединяются к поверхности металла под влиянием электрических сил, образуя слой заряженных частиц. Диссоциация происходит, когда ионы электролита разделяются на положительно и отрицательно заряженные частицы в растворе. Реакция между ионами электролита и атомами металла может привести к образованию новых соединений или изменению состояния поверхности металла.
Взаимодействие электролита с металлом имеет различные последствия, как положительные, так и отрицательные. Положительные последствия включают защитные свойства, которые электролит может обеспечить металлу, предотвращая его коррозию или активацию. Отрицательные последствия включают разрушение поверхности металла, образование осадков на поверхности и изменение свойств материала. Поэтому важно понимать механизмы взаимодействия и контролировать условия, в которых происходит это взаимодействие, чтобы минимизировать отрицательные последствия и оптимизировать использование металлов в различных сферах деятельности.
Роль электролита во взаимодействии с металлом
Электролит, как раствор или расплав, играет важную роль во взаимодействии с металлом. Взаимодействие происходит в результате образования электролитической ячейки, где металл выступает в роли анода, а электролит - в роли катода.
Основная задача электролита во взаимодействии с металлом - обеспечение процесса электрохимической коррозии. Электролит содержит ионы, которые мигрируют к металлу, вызывая окисление его поверхности и детериорацию материала. Электролит также обеспечивает передачу электронов и ионов, предотвращая образование пассивной оксидной пленки на поверхности металла.
Одним из механизмов взаимодействия электролита с металлом является коррозия посредством электролитического растворения металла. В процессе коррозии электролит осуществляет электропроводность между анодной и катодной областями поверхности металла, вызывая растворение металлических ионов из анода в электролит и образование соединений металла с электролитом.
Кроме того, электролит может оказывать защитное действие на металл путем формирования пассивной пленки на его поверхности. Например, в случае образования пассивной оксидной пленки на поверхности металла, электролит может предотвратить дальнейшую коррозию, обеспечивая защиту металла от действия агрессивной среды.
Влияние электролита на поверхность металла
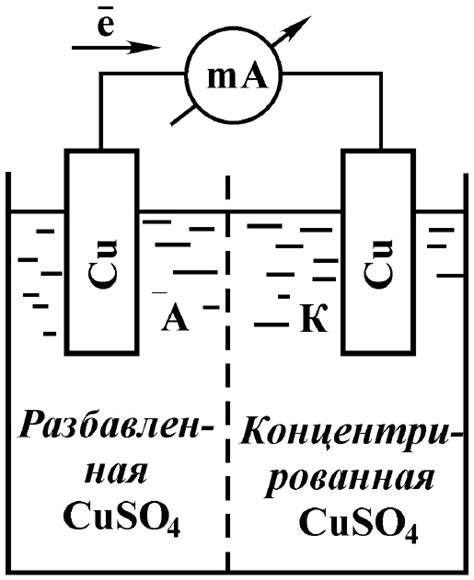
Взаимодействие электролита с поверхностью металла имеет значительное влияние на его свойства и структуру. При контакте с электролитом, на поверхности металла образуется электрохимическая двухслойная структура. Внутри слоя электролита образуются ионы, а на поверхности металла образуется слой, состоящий из различных веществ и соединений.
Влияние электролита на поверхность металла проявляется в различных процессах и явлениях. Одним из таких явлений является коррозия металла. При контакте с агрессивным электролитом, металлическая поверхность может подвергаться разрушению и образованию оксидов или гидроксидов металла.
Другим влиянием электролита на поверхность металла является его полимеризация или осаждение. Электролит может накапливаться на поверхности металла и образовывать защитный слой. Это может привести к повышению коррозионной стойкости металла и предотвращению его дальнейшего разрушения.
Также электролит может влиять на структуру поверхности металла, изменяя его морфологию. Например, при электрохимической полировке металла в электролите, на его поверхности могут образовываться микроскопические выступы или пустоты, что может привести к улучшению оптических и механических свойств металла.
Таким образом, взаимодействие электролита с поверхностью металла имеет важное значение для понимания и контроля его свойств и поведения. Изучение этих явлений позволяет разрабатывать новые методы обработки и защиты металлов, а также применять их в различных областях, включая электронику, металлургию и нанотехнологии.
Химические реакции при взаимодействии электролита с металлом

Взаимодействие электролита с металлом вызывает различные химические реакции, которые могут иметь серьезные последствия для металла и окружающей среды. Одной из основных реакций является оксидация металла, при которой его поверхность покрывается оксидной пленкой. Оксидация может привести к образованию пассивной защитной пленки, которая защищает металл от дальнейшего разрушения или, наоборот, к разрушению металла и образованию коррозии.
Кроме того, при взаимодействии электролита с металлом может происходить обратная реакция – восстановление металла, при котором металлические ионы из электролита могут отдавать электроны и образовывать металлическую отложение на поверхности металла. Такие реакции играют важную роль при проведении электрохимических процессов, таких как электролиз или гальваническая коррозия.
Взаимодействие электролита с металлом может сопровождаться также рядом реакций, таких как гидролиз, образование осажденных соединений, растворение металла и т.д. Все эти реакции влияют на поведение металла в электролите и его стойкость к коррозии.
Понимание химических реакций при взаимодействии электролита с металлом является важным для разработки методов защиты от коррозии и оптимизации различных технологических процессов, особенно в области электрохимии и электролитического осаждения металла.
Электролитическая коррозия и ее последствия

Электролитическая коррозия - это процесс разрушения металла под воздействием электролита, который является проводником электричества. В данном случае электролитом чаще всего выступает вода, однако могут использоваться и другие растворы, например, кислотные или щелочные.
При электролитической коррозии происходит химическое взаимодействие металла с электролитом, что приводит к образованию оксидов и гидроксидов металла. В результате этого процесса металл постепенно разрушается и образуются коррозионные очаги.
Одним из наиболее опасных последствий электролитической коррозии является потеря прочности металлических конструкций и деталей. Возникающие коррозионные очаги приводят к появлению трещин и повреждений, что может привести к аварийным ситуациям и несчастным случаям.
Для предотвращения электролитической коррозии необходимо применять различные защитные меры. Одним из методов является использование антикоррозионных покрытий на металлических поверхностях. Также можно применять методы катодной и анодной защиты, которые заключаются в подключении дополнительных элементов к металлу для контроля электролитических процессов.
В заключение, электролитическая коррозия является серьезной проблемой для металлических конструкций и деталей, так как она приводит к их разрушению и потере прочности. Для предотвращения коррозии необходимо применять соответствующие защитные меры, что позволит продлить срок службы и обеспечить безопасность эксплуатации металлических изделий.
Влияние электролита на свойства металла
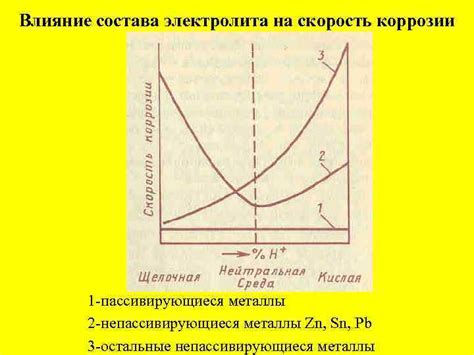
Электролит имеет значительное влияние на свойства металла. Взаимодействие электролита с металлом приводит к различным изменениям, которые могут как улучшить, так и ухудшить качество материала. От электролита зависит его коррозионная стойкость, электропроводность и другие характеристики.
Основной механизм, через который электролит влияет на металл, - это коррозия. Коррозия - это процесс разрушения металла под воздействием химических реакций с окружающей средой. Электролит, находящийся в контакте с металлом, может содержать различные химические элементы, которые приводят к коррозии и повреждению материала.
Кроме коррозии, электролит также может изменить металлическое образование вещества. Под воздействием электролита могут происходить электрохимические процессы, в результате которых металл может разлагаться или образовываться вторичные соединения. Это может привести к изменению структуры и свойств металла.
Передовые промышленные методы обработки металлов, такие как электроосаждение, основаны на использовании электролита. Электролиты активно применяются для нанесения покрытий на металлические поверхности с целью улучшения их защитных свойств или придания им декоративного вида.
Коррозионная стойкость металла может быть усилена или понижена с помощью контроля состава электролита и применения соответствующих защитных покрытий. Электролиты также могут использоваться для деблокировки и ремонта металлических деталей, восстановления их характеристик и продления срока службы.
Итак, электролит оказывает значительное влияние на свойства металлов, причем данное влияние может быть как положительным, так и отрицательным. Понимание и контроль взаимодействия электролита с металлом позволяют эффективно улучшать качество и эксплуатационные характеристики металлических материалов в различных областях применения.
Вопрос-ответ

Какие механизмы взаимодействия существуют между электролитом и металлом?
Взаимодействие между электролитом и металлом может происходить через такие механизмы, как растворение металла в электролите, электрохимическая реакция, образование оксидной пленки на поверхности металла и обратноосмотический процесс.
Что происходит при растворении металла в электролите?
При растворении металла в электролите происходит образование ионов металла, которые переходят в раствор и образуют положительные ионы металла. Это происходит под воздействием электрического поля, созданного электролитом.
Какие последствия могут быть при взаимодействии электролита с металлом?
При взаимодействии электролита с металлом могут возникать различные последствия, включая коррозию металла, образование оксидной пленки на поверхности металла, изменение электрохимического потенциала металла и т.д.