Химическая связь между атомами одного металла является важным явлением в химии и имеет свои особенности и свойства. В зависимости от особенностей строения и взаимодействия атомов, металлические связи могут быть разных видов.
Одним из основных видов химической связи между атомами одного металла является металлическая связь. Она характеризуется высокой электропроводностью и термической проводимостью. Металлическая связь основана на обмене свободными электронами между атомами металла, образуя так называемое "море электронов". Это позволяет металлам обладать хорошей пластичностью и деформируемостью, что объясняет их способность к формированию различных изделий и конструкций.
Еще одним видом химической связи между атомами одного металла является ионная связь. Она возникает между атомами, в результате которой один атом отдает электроны, а другой атом их принимает. У металлов ионная связь может наблюдаться, когда атомы металла переходят из одной степени окисления в другую при образовании ионов. Ионная связь оказывает влияние на химические и физические свойства металла, такие как температура плавления и кристаллическая структура.
Еще один вид химической связи между атомами одного металла - это ковалентная связь. Эта связь возникает путем обмена электронами между атомами металла, при котором оба атома имеют общие электроны. Ковалентная связь является более слабой, чем металлическая и ионная связи, но все же имеет заметное влияние на химические свойства металла, такие как прочность и твердость.
В итоге, различные виды химической связи между атомами одного металла обуславливают его уникальные свойства и влияют на его способность взаимодействовать с другими веществами и конструкциями. Изучение этих связей является важным для понимания и применения металлов в различных отраслях промышленности и науки.
Металлическая связь: межатомная сила вещества

Металлическая связь — это особый тип химической связи, возникающий между атомами одного и того же металла. В отличие от ионной или ковалентной связи, металлическая связь характеризуется высокой подвижностью и электропроводностью материала.
Межатомная сила вещества в металлической связи обеспечивается общими электронами валентной оболочки металлических атомов. Атомы в металле тесно упакованы и образуют кристаллическую решетку. Каждый атом отдает один или несколько электронов в общий электронный газ.
Металлическая связь характеризуется несколькими основными свойствами. Во-первых, металлы обладают высокой термической и электропроводностью благодаря свободному передвижению электронов внутри металлической решетки. Это объясняет их способность проводить электрический ток и тепло.
Во-вторых, металлы обладают хорошей пластичностью и деформируемостью благодаря свободному скольжению атомов друг относительно друга. Межатомная связь позволяет атомам перемещаться без разрушения решетки, что делает металлы удобными для литья, ковки и проката.
В-третьих, металлическая связь обуславливает специфические оптические свойства металлов, такие как блеск и отражательность. Свободные электроны в металлической решетке способны поглощать и испускать световые волны в видимом диапазоне, что придает металлам характерный металлический блеск.
Таким образом, металлическая связь обеспечивает межатомную силу вещества, которая определяет основные характеристики и свойства металлических материалов. Она обеспечивает высокую электропроводность, теплопроводность, пластичность и оптическую отражательность металлов, что делает их ценными и широко используемыми материалами в различных отраслях промышленности.
Ионная связь: взаимодействие заряженных частиц
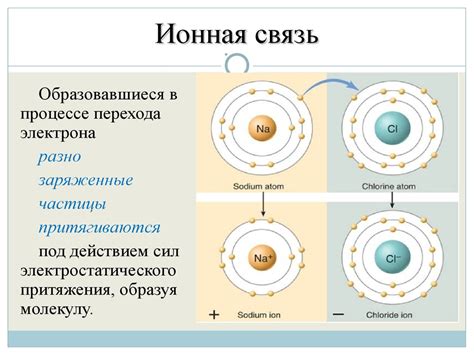
Ионная связь - одна из форм химической связи, основанная на взаимодействии электрически заряженных частиц - ионов. При ионной связи один атом отдает электроны, а другой атом принимает их, образуя положительные и отрицательные ионы.
Основные характеристики ионной связи:
- Электронный перенос: при ионной связи происходит перенос электронов от одного атома к другому. Атом, отдающий электрон, становится положительно заряженным, а атом, принимающий электрон, становится отрицательно заряженным.
- Силы притяжения: заряженные ионы притягивают друг друга электростатическими силами, образуя прочную связь между собой.
- Кристаллическая структура: ионные соединения образуют кристаллическую структуру, так как положительные и отрицательные ионы должны занимать определенное положение в решетке.
- Характеристики соединения: ионные соединения обладают высокой температурой плавления и кипения, а также обычно обладают хорошей проводимостью электрического тока в расплавленном или растворенном состоянии.
Ионная связь является основой для образования множества веществ, таких как соли и металлы. Эта связь играет важную роль в различных химических процессах и имеет широкое применение в различных областях науки и техники.
Ковалентная связь: общие электроны и молекулярное образование

Ковалентная связь - это вид химической связи между атомами, основанный на общей паре электронов между двумя или более атомами. В отличие от ионной связи, где атомы обмениваются электронами и становятся ионами, в ковалентной связи общие электроны образуют электронные пары, причем они принадлежат обоим атомам одновременно.
Образование молекул является одним из основных свойств ковалентной связи. Пары общих электронов, называемые бонд-парами, образуются между атомами и удерживают их вместе в виде молекулы. В ковалентно связанных молекулах можно наблюдать различные геометрические формы, которые определяются взаимным расположением атомов и электронных пар.
Ковалентная связь обладает несколькими особыми свойствами. Во-первых, она характеризуется сильной прочностью, так как энергия связи между атомами обычно очень высока. Во-вторых, ковалентные связи могут быть полярными или неполярными в зависимости от разности электроотрицательности атомов, образующих связь. Полярные ковалентные связи создаются между атомами с различной электроотрицательностью и создают вещества с положительными и отрицательными зарядами, что может приводить к образованию дипольных молекул.
В целом, ковалентная связь является важным явлением в химии, поскольку она позволяет образовывать стабильные молекулы с участием атомов одного металла. Ковалентная связь также определяет многие химические и физические свойства веществ, такие как электропроводность, теплопроводность и магнитные свойства.
Ван-дер-Ваальсова связь: слабые межмолекулярные силы
Ван-дер-Ваальсова связь является одной из разновидностей химической связи между атомами одного металла. Эта связь образуется благодаря слабым межмолекулярным силам, исходящим от временно образующихся диполей.
Основной характеристикой Ван-дер-Ваальсовой связи является ее слабая сила. Это обуславливается тем, что межмолекулярные взаимодействия, на которых основана эта связь, происходят на больших расстояниях между атомами. Такие взаимодействия имеют длительный характер и ослабевают с увеличением расстояния между атомами.
Особенностью Ван-дер-Ваальсовой связи является то, что она может существовать даже в тех случаях, когда отталкивающие силы между атомами превышают притягивающие. Такая связь является дополнительной к более сильным и устойчивым химическим связям, таким как ионные или ковалентные связи.
Слабые межмолекулярные силы, обусловленные Ван-дер-Ваальсовой связью, играют важную роль в различных химических процессах. Они могут влиять на вязкость жидкостей, кристаллическую структуру веществ и их сублимационные свойства. Кроме того, эти силы могут оказывать влияние на фазовые переходы и адсорбцию веществ.
Металлическая ионная связь: особенности и применение в материаловедении

Металлическая ионная связь является одной из основных форм химической связи в металлах. Она основана на взаимодействии положительно заряженных ионов металла и свободно движущихся электронов. Данная связь характеризуется высокой прочностью и эластичностью, что делает металлы прочными и пластичными материалами.
Особенностью металлической ионной связи является возможность свободного движения электронов в металлической решетке. Это обусловлено отсутствием строгого определения положения электронов и возможностью их перемещения от одного металлического иона к другому. Этот факт обеспечивает высокую электропроводность и теплопроводность металлов.
Металлическая ионная связь находит широкое применение в материаловедении. Благодаря своим свойствам, металлы являются основными строительными материалами, используются в производстве различных механизмов, электронных устройств, проводов и кабелей. Также металлическая ионная связь используется в процессе выделения металлов из руды и производства сплавов, которые имеют специальные свойства и применяются в различных промышленных отраслях.
Вопрос-ответ

Какие виды химической связи могут существовать между атомами одного металла?
Между атомами одного металла могут существовать два основных вида химической связи: ионная связь и металлическая связь.
Что такое ионная связь между атомами одного металла?
Ионная связь между атомами одного металла возникает, когда между атомами образуются положительные и отрицательные ионы. В такой связи электроны переносятся с одного атома на другой, образуя ионы с противоположными зарядами. Ионная связь ведет к образованию кристаллических структур, таких как соли и оксиды.
В чем заключается основная особенность ионной связи между атомами одного металла?
Основная особенность ионной связи между атомами одного металла заключается в том, что образование положительных и отрицательных ионов приводит к сильному притяжению этих ионов друг к другу. Это притяжение обеспечивает прочность ионной связи и делает металлы твердыми и хрупкими.
Что такое металлическая связь между атомами одного металла?
Металлическая связь между атомами одного металла возникает, когда электроны в валентной оболочке атомов металла не принадлежат ни к одному конкретному атому, а свободно двигаются по всей структуре металла. Такая связь позволяет атомам металла образовать кристаллическую решетку и обладать высокой проводимостью электричества и тепла.
Какие свойства характерны для металлической связи между атомами одного металла?
Металлическая связь между атомами одного металла обладает несколькими характерными свойствами. Во-первых, она обеспечивает высокую проводимость электричества и тепла. Во-вторых, атомы металла в металлической связи могут легко двигаться друг относительно друга, что делает металлы хорошими проводниками тока и хорошо подверженными обработке. В-третьих, металлическая связь обусловливает блеск и характерный металлический вид металлов.
