Металлы являются одними из наиболее распространенных и важных материалов в промышленности и строительстве. Они обладают множеством уникальных свойств, которые делают их незаменимыми в ряде отраслей. Для достижения нужных характеристик и свойств металлы соединяют между собой различными способами.
Одним из основных способов соединения металлов является сварка. При сварке металлы нагревают до определенной температуры, после чего они сливаются воедино. Сварка может выполняться различными способами: дуговой, газовой или лазерной. Каждый из них имеет свои преимущества и применяется в зависимости от конкретных условий и требований проекта. В результате сварки получается прочное и неразъемное соединение, которое обладает высокой прочностью и устойчивостью к внешним воздействиям.
Кроме сварки, металлы могут быть соединены с помощью механического способа. Один из наиболее распространенных методов механического соединения - болтовое соединение. Оно заключается в использовании болтов и гаек, которые надежно фиксируют две или более детали вместе. Болтовое соединение является простым в исполнении и обладает высокой надежностью. Кроме того, оно позволяет легко разбирать и собирать соединение, что облегчает обслуживание и ремонт.
Таким образом, существует несколько разновидностей соединений металла, каждый из которых обладает своими особенностями и преимуществами. Выбор конкретного способа зависит от требований и условий проекта, а также от желаемых характеристик и свойств конечного изделия.
Металл и его химические связи
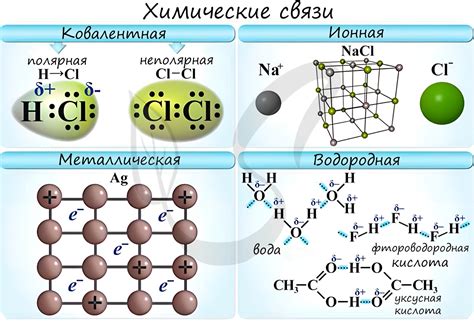
Металлы являются одной из основных групп химических элементов, обладающих способностью образовывать специфические химические связи. Это особенность металлической структуры, которая отличается от связей, присущих другим группам элементов, таким как неметаллы.
Основной тип связи в металлах – металлическая связь, которая характеризуется плодотворным взаимодействием между свободно движущимися электронами и ионными решетками металла. Это свойство обеспечивает металлам высокую электропроводность и теплопроводность, а также их способность к деформации и пластичности.
В связи с металлической связью металлы образуют уникальные металлические структуры, которые определяют их физические и химические свойства. Металлы могут быть одноатомными, как например серебро или золото, или состоять из сложных ионных решеток, как в случае с медью или железом.
Кроме того, металлы способны образовывать различные химические соединения с другими элементами. Такие соединения называются металлоорганическими или неорганическими соединениями металлов. Они могут обладать различными свойствами и находить широкое применение в различных отраслях промышленности и науки.
Основные понятия: металл, атом, элемент, связь, молекула
Металл - это материал, обладающий характерными свойствами, такими как высокая теплопроводность, электропроводность и пластичность. Металлы встречаются в природе в виде руд и используются в различных отраслях промышленности.
Атом - это основная структурная единица вещества. Атомы металлов обладают характерными свойствами, такими как тяжелая масса и наличие свободных валентных электронов.
Элемент - это вещество, состоящее из атомов одного вида. Металлы представляют собой отдельный класс элементов в периодической таблице Менделеева. Они характеризуются высокой проводимостью электричества и теплоты, а также способностью образовывать сплавы с другими металлами.
Связь - это взаимодействие атомов, при котором образуется молекула или кристаллическая решетка. В металлах связи между атомами называются металлической связью. Она характеризуется наличием свободных электронов, которые образуют общую электронную оболочку и могут свободно двигаться между атомами.
Молекула - это частица, состоящая из двух или более атомов, связанных между собой химической связью. В случае металлов, молекул нет, так как они образуют кристаллическую решетку, в которой атомы расположены в определенном порядке.
Принципы образования химической связи в металлах

1. Металлическая связь
Принцип образования химической связи в металлах называется металлической связью. Эта связь основана на взаимодействии свободных электронов, которые образуют так называемое "облако" электронов в металлической решетке. Эти электроны свободно передвигаются между атомами металла и создают металлические свойства, такие как теплопроводность и электропроводность.
2. Графитизация
Некоторые металлы могут образовывать химическую связь с графитом, что называется графитизацией. Графит представляет собой слоистую структуру углерода, в которой атомы металла встраиваются между слоями углерода. Это приводит к образованию сплавов, имеющих специфические свойства.
3. Ионная связь
Некоторые металлы образуют химическую связь с другими элементами, что называется ионной связью. В этом случае атом металла отдает электрон(-ы), образуя положительный ион, который образует ионные связи с отрицательно заряженными ионами другого элемента. Это ведет к образованию соединений, таких как соли и оксиды.
4. Ковалентная связь
Некоторые металлы могут образовывать ковалентную связь с другими элементами, когда электроны общуются и заполняют общие энергетические уровни атомов. Ковалентная связь в металлах проявляется в образовании соединений, таких как карбиды и нитриды.
5. Сводные соединения
Сложные металлические соединения могут включать в себя несколько различных типов связей, таких как металлическую, ионную и ковалентную связи. Эти соединения имеют сложную структуру и обладают уникальными свойствами, они могут быть использованы в разных промышленных процессах и технологиях.
Ионные соединения
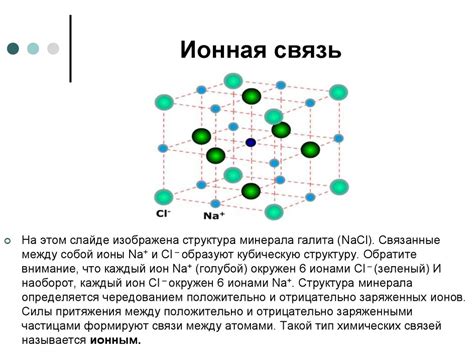
Ионные соединения - это тип химических соединений, в которых положительно заряженные ионы (катионы) притягиваются к отрицательно заряженным ионам (анионы) посредством электростатического взаимодействия. Такие соединения образуются между металлами и неметаллами.
Образование ионных соединений происходит путем переноса электронов от одного атома к другому. Металлы, обладающие низкой электроотрицательностью, отдают свои электроны неметаллам с высокой электроотрицательностью. В результате такого переноса электронов образуются ионы с противоположными зарядами.
Свойства ионных соединений:
- Высокая температура плавления и кипения: ионные соединения имеют высокую энергию решетки, что требует большого количества энергии для разрушения сил электростатической привлекательной силы между ионами.
- Растворимость в воде: ионные соединения обычно растворяются хорошо в воде, так как вода способна раздробить электростатические силы, существующие между ионами.
- Электропроводность: в расплавленном виде или в растворе ионные соединения могут быть хорошими электролитами, так как ионы могут двигаться свободно и проводить электрический ток.
Важно отметить, что ионные соединения обладают хрупкостью, так как при нарушении кристаллической структуры силы притяжения между ионами прекращают действовать и соединение разрушается. Кроме того, они образуют соли, которые широко используются в различных областях, включая химическую, пищевую и фармацевтическую промышленность.
Определение и свойства ионных соединений

Ионные соединения представляют собой тип химических соединений, образующихся в результате притяжения между положительно и отрицательно заряженными ионами. Они обычно образуются между металлами и неметаллами.
Одной из ключевых особенностей ионных соединений является то, что они образуются благодаря электростатическому притяжению между разноименными ионами. В ионных соединениях отрицательно заряженные атомы, называемые анионами, и положительно заряженные атомы, называемые катионами, образуют кристаллическую структуру.
Ионные соединения обычно обладают высокой температурой плавления и кипения, так как их атомы сильно связаны электростатическими силами притяжения. Они образуют кристаллические структуры и не проводят электрический ток в твердом состоянии, но способны проводить электрический ток в расплавленном состоянии или в растворе, так как ионы могут двигаться свободно.
Ионные соединения также обладают хорошими термическими и электрическими свойствами. Они часто используются в различных промышленных процессах, включая производство стекла, керамики и солей. Кроме того, многие ионные соединения имеют важное значение в биологических системах и в медицине.
Процесс образования и структура ионных соединений
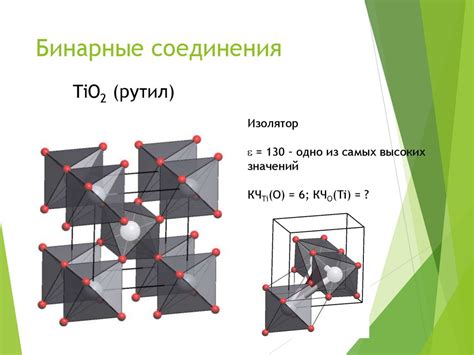
Ионные соединения являются одним из основных типов химических соединений, образованных металлами и неметаллами. Образование ионных соединений связано с передачей электронов от одного атома к другому.
Процесс образования ионного соединения начинается с образования ионов - заряженных атомов или групп атомов. Металлы, как правило, образуют положительные ионы, потому что отдают электроны, а неметаллы образуют отрицательные ионы, так как получают электроны.
Структура ионной сетки основывается на притяжении противоположных зарядов. Ионы положительной и отрицательной зарядности притягиваются друг к другу, что обеспечивает их устойчивость. Ионы металла располагаются в регулярной кристаллической решетке, а ионы неметалла окружают их.
Структура ионной сетки может быть представлена в виде электростатической модели, где каждый ион окружен своими соседними ионами. Также возможны различные комбинации ионов металла и неметалла, что приводит к различным структурам и свойствам ионных соединений.
Ковалентные соединения
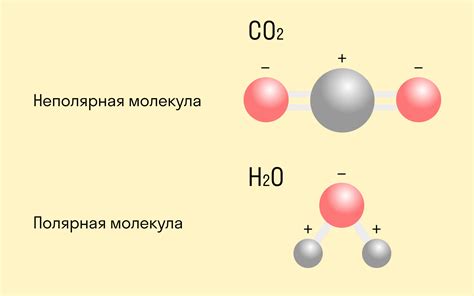
Ковалентные соединения представляют собой тип химических соединений, образованных путем обмена электронами между атомами. В этих соединениях электроны общего пользования образуют ковалентные связи между атомами и обеспечивают стабильность структуры соединения.
Одной из особенностей ковалентных соединений является их высокая степень полярности. Это связано с тем, что электроны общего пользования могут быть неодинаково притягиваемы атомами, что приводит к образованию полярного электрического заряда.
Ковалентные соединения обладают определенными свойствами, такими как низкая температура плавления и кипения, низкая электропроводность и химическая инертность в некоторых условиях.
Примерами ковалентных соединений являются молекулы воды (H2O), аммиак (NH3), метан (CH4) и другие органические и неорганические соединения.
Структура ковалентных соединений
Ковалентные соединения представляют собой связи между атомами, основанные на обмене электронами. В отличие от ионных соединений, где электроны передаются от одного атома к другому, в ковалентных соединениях электроны общие между атомами.
Ковалентные соединения обычно образуются между неметаллами. Основной строительный блок ковалентных соединений - молекула. Молекулярная структура состоит из атомов, связанных вместе общими электронными парами. Обычно в ковалентных соединениях используются схемы Льюиса, чтобы наглядно представить структуру и связи между атомами.
В ковалентных соединениях могут присутствовать одинарные, двойные или тройные связи между атомами. Одинарная связь образуется при обмене одной пары электронов, двойная - при обмене двух пар электронов, тройная - при обмене трех пар электронов. Уровень энергии связи в ковалентном соединении зависит от числа связей и электронной структуры атомов.
Ковалентные соединения обладают рядом характеристических свойств. Они обычно имеют низкую температуру плавления и кипения, так как молекулы в ковалентных соединениях меньше подвержены электростатическим силам притяжения, чем ионы в ионных соединениях. Ковалентные соединения также обладают низкой проводимостью электрического тока, так как электроны в молекулах не свободно передвигаются.
Основные свойства ковалентных соединений и их классификация
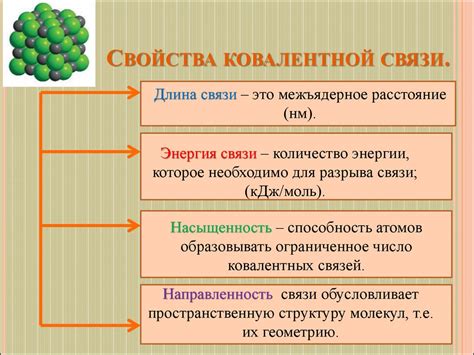
Ковалентные соединения - это химические соединения, в качестве связи между атомами которых выступают совместно используемые электроны. В отличие от ионных соединений, ковалентные соединения характеризуются связью, при которой осуществляется обмен электронами между атомами.
Основными свойствами ковалентных соединений являются:
- Низкая температура плавления и кипения. Ковалентные соединения часто обладают низкими температурами плавления и кипения, так как их молекулы удерживаются вместе слабыми ковалентными связями;
- Молекулярная структура. Ковалентные соединения образуются между неметаллами и имеют молекулярную структуру, то есть состоят из отдельных молекул, которые могут взаимодействовать между собой слабыми межмолекулярными силами;
- Электронная нейтральность. Молекулы ковалентных соединений обычно являются электронейтральными, то есть содержат одинаковое количество электронов и протонов;
- Устойчивость. Ковалентные соединения обычно обладают высокой устойчивостью, так как формирование ковалентных связей происходит за счет обмена электронами, что уменьшает энергию системы и делает ее более устойчивой.
Классификация ковалентных соединений основана на типе связи между атомами. Существуют следующие типы ковалентных связей:
- Полярные ковалентные связи, при которых электроны распределены неравномерно между атомами. Один атом притягивает электроны сильнее, чем другой, что создает разницу зарядов и вызывает полярность связи;
- Неполярные ковалентные связи, при которых электроны равномерно распределены между атомами. В таких связях нет разницы зарядов и они не обладают полярностью;
- Множественные ковалентные связи, при которых между атомами образуется более одной общей пары электронов. Это может быть двух-, трех- или даже четырехкратная связь.
Вопрос-ответ

Какие разновидности соединений металла существуют?
Существует несколько разновидностей соединений металла, включая механические соединения, сварку, пайку и клеение. Каждый из этих способов обладает своими свойствами и применяется в различных сферах промышленности.
Какие свойства механических соединений металла?
Механические соединения металла обеспечивают прочное и надежное соединение металлических деталей путем скрепления или завальцовки. Они отличаются высокой прочностью и устойчивостью к воздействию внешних сил. Однако такие соединения сложнее и более затратные в процессе монтажа и демонтажа.
Какие свойства сварки металла?
Сварка металла представляет собой процесс соединения металлических деталей посредством их плавления и последующего затвердевания. Сварные соединения обладают высокой прочностью и обеспечивают герметичность соединенных деталей. Они также обладают резистентностью к воздействию внешних факторов, таких как вибрации и термические нагрузки.
