В химии металлы играют важную роль. Знание их химических свойств важно для понимания многих процессов, происходящих в нашей жизни. В этом видеоуроке для учащихся 9 класса мы рассмотрим основные химические свойства металлов, которые помогут вам лучше понять и запомнить этот раздел химии.
Металлы обладают рядом характерных химических свойств. Они могут взаимодействовать с кислотами, окислителями и веществами, содержащими кислород. Мы рассмотрим образование солей при взаимодействии металлов с кислотами, реакции металлов с водой, а также реакции окисления металлов, например, образование оксидов.
Важно помнить, что разные металлы проявляют разные химические свойства. Некоторые металлы, такие как натрий и калий, реагируют с водой с выделением горючего газа. Другие металлы, такие как железо и медь, могут реагировать с кислотами, образуя соли и выделяя водород. Видеоурок поможет вам разобраться в этих зависимостях и понять, какие металлы в каких условиях проявляют определенные химические свойства.
Основные свойства металлов
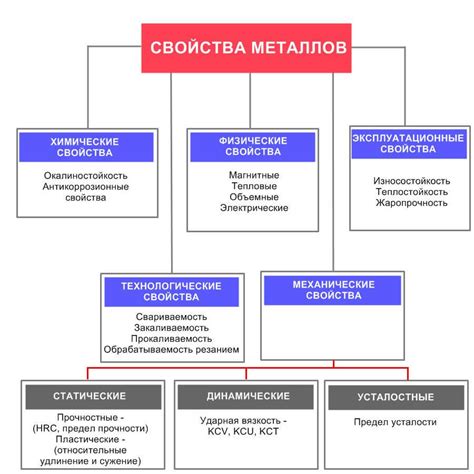
Проводимость электричества и тепла: Металлы являются хорошими проводниками электричества и тепла. Это связано с наличием свободных электронов в их кристаллической решетке, которые способны свободно перемещаться и передавать электрический ток или тепловую энергию.
Пластичность и формовочность: Металлы обладают способностью изменять свою форму без разрушения. Они могут быть легко раскатаны, прокатаны, вытянуты и изготовлены в различные изделия. Это свойство обусловлено отсутствием жесткости в кристаллической решетке металлов и их способностью к деформации при воздействии силы.
Металлический блеск: Металлы обладают характерным блеском, который называется металлическим блеском. Это связано с тем, что свободные электроны в металлах способны поглощать и переизлучать свет, что создает блестящую поверхность.
Тугоплавкость и высокая точка плавления: Металлы обладают высокой температурой плавления. Это позволяет использовать их в высокотемпературных процессах и конструкциях, где требуется высокая стойкость к нагреву и плавление.
Магнитные свойства: Некоторые металлы, такие как железо, никель и кобальт, обладают магнитными свойствами. Это связано с особым расположением и движением электронов в кристаллической решетке металла, что создает магнитное поле.
Химическая активность: Металлы могут реагировать с другими веществами и образовывать различные соединения. Некоторые металлы, такие как натрий или калий, очень активны химически и легко взаимодействуют с водой или кислородом из воздуха. Другие металлы, например, золото или платина, не реагируют с большинством реагентов, что делает их стойкими к химическим воздействиям.
Процессы окисления и восстановления металлов

Окисление и восстановление являются важными процессами, происходящими с металлами. Окисление - это процесс, в результате которого металл превращается в оксид, а восстановление - наоборот, оксид превращается в металл.
Оксиды металлов образуются при взаимодействии металлов с кислородом. Они обладают характерными свойствами и широко используются в промышленности. Оксиды металлов имеют различные цвета, например, оксид железа (III) - красный, оксид меди (II) - черный и т.д.
Процессы окисления и восстановления могут происходить в присутствии растворителя или без него. Например, вода может действовать как растворитель при взаимодействии металлов с кислородом.
Окисление металлов происходит при контакте с кислородом, воздухом или водой. Металлы при окислении образуют оксидные пленки на своей поверхности, что может привести к коррозии. Примерами окисления металлов являются окисление железа при ржавлении и окисление алюминия при образовании оксидной пленки.
Восстановление металлов происходит при удалении кислорода из оксида. Это может быть осуществлено путем нагревания оксида или взаимодействия с веществом, способным отдавать электроны. Процесс восстановления обратный окислению и позволяет получить металл из оксида.
Продукты окисления и восстановления металлов могут иметь различные свойства и применения. Например, оксид цинка служит основным компонентом белого цинкового покрытия, а полученные металлы могут использоваться в различных отраслях промышленности, таких как судостроение, авиация и электротехника.
Реакция металлов с кислотами

Металлы могут вступать в реакцию с различными видами кислот. Под воздействием кислот металлы могут выделять водород и образовывать соответствующие соли.
Кислота – это вещество, которое в растворе отдает протонный катион (водородный ион, H+). Реакция металлов с кислотами основана на обмене протоном между кислотой и металлом.
Металлы, находящиеся выше в ряду напряжения напряжённости реактивности, обычно реагируют с кислотами. Например, щелочные металлы, такие как натрий и калий, образуют соли, выделяя водород при реакции с кислотами. Металлы, находящиеся ниже в ряду напряжения, могут не реагировать или реагировать очень медленно.
Реакция металлов с кислотами может иметь различный характер в зависимости от типа кислоты. Например, металлы могут реагировать с сильными минеральными кислотами, такими как соляная кислота (HCl) или серная кислота (H2SO4), образуя соответствующие соли и выделяя водород. С другой стороны, металлы могут не реагировать с слабыми органическими кислотами.
Поэтому, реакция металлов с кислотами является важной темой изучения химических свойств металлов и помогает понять их реактивность и возможные применения.
Реакция металлов с щелочами

Реакция металлов с щелочами является одной из важных тем в химии. Щелочи, такие как гидроксид натрия или гидроксид калия, обладают высокой активностью и могут вызывать реакции с различными металлами.
Когда металлы вступают в реакцию с щелочами, образуется соль и выделяется водород. При этом происходит окислительно-восстановительная реакция, при которой металл окисляется, а водород восстанавливается.
Металлы, находящиеся в верхней части электрохимического ряда, такие как литий, натрий и калий, обладают высокой активностью и реагируют с щелочами быстро и интенсивно. Например, литий при реакции с гидроксидом натрия образует соль лития и гидроксид иода:
- 2Li + 2NaOH → 2LiOH + H2
Более тяжелые металлы, такие как железо или медь, обычно не реагируют с щелочами, так как они находятся ниже в ряду активности металлов и менее активны.
Реакция металлов с щелочами может протекать при обычных условиях температуры и давления. Эта реакция является важной для практического применения, например, при получении гидрогена.
Реакция металлов с водой

Реакция металлов с водой является одним из важных химических свойств металлов. Некоторые металлы реагируют с водой интенсивно, образуя гидроксиды и выделяясь водородом.
Например, щелочные металлы, такие как натрий и калий, реагируют с водой взрывообразно. При контакте с водой они выделяются водородом, который может воспламеняться, и образуют гидроксиды щелочных металлов.
Ряд металлов, включая магний, алюминий и цинк, также реагируют с водой, но не так интенсивно, как щелочные металлы. При контакте с водой они образуют соответствующие гидроксиды и выделяются водородом.
Однако некоторые металлы, такие как железо и медь, не реагируют с водой при обычных условиях. Они могут реагировать только с паром воды или горячей водой, образуя соответствующие гидроксиды и выделяясь водородом.
Реакция металлов с водой может быть полезной в различных областях, например, в производстве водорода или при использовании металлов для удаления загрязнений из воды.
Реакция металлов с солями

Реакция металлов с солями – это важное химическое явление, которое можно наблюдать при взаимодействии различных металлов с солями. В ходе данной реакции образуется новое вещество – металлическая соль.
Металлы реагируют с солями, образуя водород газ и металлическую соль. Процесс реакции металлов с солями зависит от активности металла и типа соли. Металлы высокой активности, такие как натрий или калий, быстро реагируют с солями, выделяя большое количество водорода газа.
Например, взаимодействие цинка с солями свинца приводит к образованию цинковой соли и выделению водорода газа. Данная реакция является обратной к процессу электрохимического осаждения цинка.
Реакция металлов с солями также может протекать с образованием осадка. Например, при реакции железа с солями серебра образуется черный осадок серебра. При этом железо переходит в ионное состояние, а серебро осаживается на поверхности металла.
В целом, реакция металлов с солями является важным физико-химическим процессом, который позволяет получать различные вещества и применять их в разных отраслях науки и промышленности.
Активность металлов и их позиция в ряду напряжений

Активность металлов – это способность металла вступать в химические реакции с веществами. Чем выше активность металла, тем легче он вступает во взаимодействие с другими веществами. Позиция металла в ряду активности зависит от его химических свойств и реакционной способности.
Для классификации металлов по их активности применяется ряд напряжений. В этом ряду металлы упорядочены по возрастанию их активности. В ряду напряжений находятся такие металлы, как литий, калий, натрий, железо, магний, цинк и др. Также в ряду напряжений присутствуют тройные соли – соединения, образуемые двумя разными металлами.
Позиция металла в ряду напряжений определяет его способность вытеснять из раствора ионы другого металла. Если металл расположен выше в ряду напряжений, то он может вытеснить ионы другого металла из их соединения. Если же металл расположен ниже, то он не обладает достаточной активностью для вытеснения ионов из соединения.
Позиция металла в ряду напряжений также определяет его способность вступать в реакцию с кислородом. Металлы, расположенные выше по ряду напряжений, обладают способностью быстро окисляться при взаимодействии с кислородом, что проявляется в их способности гореть при нагревании на воздухе.
Вопрос-ответ

Какие химические свойства металлов рассматриваются в видеоуроке?
В видеоуроке рассматриваются такие химические свойства металлов, как их способность образовывать ионы, реакция с кислородом, их активность в реакциях с кислотами и щелочами.
Какие металлы являются самыми активными и почему?
Самыми активными металлами являются щелочные металлы (например, натрий, калий), так как они имеют низкую энергию ионизации и легко отдают свои внешние электроны, образуя положительные ионы.
