Коррозия является одним из главных проблем, с которыми сталкиваются металлические конструкции. Она приводит к постепенному разрушению материала, что может иметь серьезные последствия.
Одним из важных аспектов, которые необходимо знать о коррозии, является то, что она происходит в результате химических реакций между металлами и окружающей средой. Воздействие различных веществ на поверхность металла может вызывать его окисление и последующую деградацию.
Существует ряд веществ, которые особенно опасны для металлов. Одним из них является вода, особенно морская. Она содержит растворенные соли, которые сильно коррозируют металлы, особенно железо. Другим распространенным веществом, вызывающим коррозию, является кислота. Она способствует разрушению металла, образуя с ним химические соединения.
Важно отметить, что скорость разрушения металла зависит от различных факторов, включая тип металла, окружающую среду, температуру и влажность.
Для предотвращения коррозии металла применяются различные способы, включая использование специальных противокоррозионных материалов и покрытий. Также важно регулярно проводить осмотр и обслуживание металлических конструкций, чтобы своевременно выявлять и устранять первые признаки коррозии.
В заключение, понимание процесса коррозии и веществ, разрушающих металлы, помогает предпринять необходимые меры для защиты металлических конструкций. Знание о типах и характеристиках коррозии позволяет выбирать подходящие способы и средства для предотвращения ее развития и сохранения долговечности металлических объектов.
Вещества, разрушающие металлы

Коррозия – это процесс разрушения металлов под воздействием внешних веществ и факторов. Существует множество веществ, способных вызывать коррозию и наносить ущерб металлическим конструкциям и изделиям.
Кислоты являются одними из наиболее агрессивных веществ, разрушающих металлы. Они способны растворять и выщелачивать ионизованные металлические частицы, что приводит к образованию пористых и прогнивших участков поверхности металла.
Соли также способны наносить существенный ущерб металлам. В особенности опасны хлориды, которые усиливают электрохимическую реакцию, приводящую к коррозии.
Кислотный дождь является серьезной проблемой, особенно для металлических конструкций и изделий под открытым небом. В результате взаимодействия дождевых капель с промышленными выбросами, образуются кислотные соединения, которые на поверхности металла вызывают коррозию.
Биологические агенты также могут вызывать коррозию металлов. Например, вода, содержащая микроорганизмы или водоросли, может привести к образованию слоя биопленки на поверхности металла, что усиливает процесс коррозии.
Электролиты, такие как вода или растворы солей, создают условия для проведения электрохимической реакции, которая приводит к коррозии металлов. Особенно опасны электролиты, содержащие различные ионы, которые активно взаимодействуют с металлом.
Атмосферные факторы, такие как влажность и температурные перепады, также способствуют разрушению металлов. Под воздействием влаги и окружающей среды металлические поверхности могут образовать окисные пленки, которые могут прогнивать и усиливать процесс коррозии.
Одной из мер по защите металлических конструкций и изделий от коррозии является их покрытие защитными материалами, такими как покраска, гальваническое покрытие или использование специальных антикоррозийных составов.
Потенциально опасные реакции с металлом

Металлы, подверженные коррозии, могут реагировать с различными веществами, что может привести к нежелательным последствиям. Рассмотрим несколько примеров таких потенциально опасных реакций с металлами.
- Реакция с кислотами: Некоторые металлы, например, железо и алюминий, могут реагировать с кислотами, образуя газы взрывоопасной природы, такие как водород. При этом происходит разрушение металла и образование коррозии.
- Реакция с щелочами: Металлы, такие как цинк и алюминий, подвержены реакции с щелочными растворами. При взаимодействии этих металлов с щелочами образуется гидроген. Это может привести к разрушению металла и образованию коррозии.
- Реакция с солями: Некоторые металлы могут реагировать с солями, образуя осадки или растворяясь, что приводит к разрушению металла. Например, железо реагирует с хлоридом натрия, образуя ржавчину.
- Реакция с водой: Некоторые металлы реагируют с водой, особенно с горячей водой или паром, что приводит к образованию оксидов металлов и подверженности коррозии.
Важно помнить, что реакция металла с различными веществами может привести к коррозии, что в свою очередь может негативно сказаться на структуре и работоспособности металлических изделий. Поэтому необходимо принимать меры предосторожности и знать химические свойства и возможные реакции металлов с различными веществами.
Роль влажности в процессе коррозии

Влажность является одним из основных факторов, влияющих на процесс коррозии металлов. Когда металл находится в контакте с влажными средами, образуется электрохимическая реакция, приводящая к разрушению материала.
Вода является проводником ионов, поэтому наличие влаги в окружающей среде способствует перемещению ионов между веществами, образующими поверхность металла. Это позволяет возникать окислительно-восстановительным процессам, которые ускоряют коррозию.
Кроме того, влажность создает благоприятные условия для образования и распространения коррозионных продуктов. Поверхностная пленка из оксидов и солей, возникающая при взаимодействии металла с окружающей средой, может быть разрушена влагой, что способствует дальнейшей коррозии и повреждению металлической поверхности.
Критическая относительная влажность для старта процесса коррозии различна для разных металлов. Например, для железа она составляет примерно 50-60%, а для алюминия - около 80%. Однако, при повышении влажности, уровень коррозии усиливается и для всех металлов.
Чтобы предотвратить коррозию, необходимо контролировать влажность в окружающей среде. Это может включать сушку среды, применение антикоррозийных покрытий, регулярные проверки состояния металлических поверхностей и прочие меры защиты.
Окислительные реакции, приводящие к повреждению металла
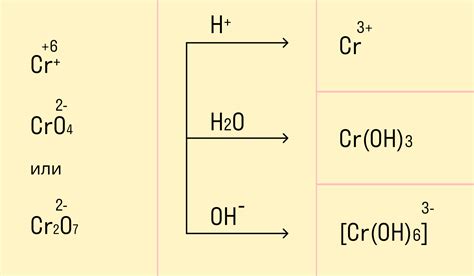
Коррозия – это процесс окисления металла, который приводит к его повреждению и потере свойств. Наиболее распространенной и разрушительной формой коррозии является электрохимическая коррозия. Эта реакция происходит при взаимодействии металла с окружающей его средой и позволяет проникать окислительным веществам внутрь материала.
Одним из основных окислителей, вызывающих коррозию металлов, является вода. Взаимодействуя с металлом, она создает реакцию, в результате которой образуются гидроксиды металлов. Водная коррозия часто наблюдается в железнодорожной отрасли, автомобильном производстве и других сферах, где металл подвергается значительному воздействию влаги.
Кроме воды, кислород также является мощным окислителем. Он образует оксиды металлов, которые могут быть в виде ржавчины или других окислов. Кислородная коррозия в основном происходит на открытом воздухе, но может наблюдаться и внутри систем, содержащих воздух с высоким содержанием кислорода, таких как сжатый воздух или воздух в помещении с протечками.
Меры по защите от коррозии

1. Покрытия и защитные покрытия:
Одним из наиболее распространенных методов защиты от коррозии является нанесение покрытий на металлические поверхности. Покрытия могут быть органическими или неорганическими, а также могут содержать специальные добавки, которые предотвращают образование коррозии. Для прочного защитного слоя может использоваться краска, эмаль, лак или специальные антикоррозионные составы.
2. Изменение химического состава:
Химические реакции между металлами и веществами, способствующими коррозии, могут быть предотвращены путем изменения химического состава металла. Например, добавление специальных легированных элементов в сталь позволяет повысить ее сопротивление коррозии. Также возможно приложение внешних антикоррозионных слоев на поверхность металла.
3. Катодная защита:
Катодная защита – это метод, основанный на создании электрохимической системы, в которой металл, который необходимо защитить, выступает в роли катода. В этом случае внешний источник тока создает противоположный потенциал для уменьшения скорости коррозии металла.
4. Выбор специальных материалов:
При эксплуатации металлических конструкций в условиях повышенной агрессивности окружающей среды имеет смысл выбирать специальные материалы, которые обладают повышенной устойчивостью к коррозии. Например, могут применяться нержавеющие стали, алюминий, пластиковые или полимерные материалы, которые не подвержены коррозии.
5. Регулярная проверка и обслуживание:
Защита от коррозии требует постоянного внимания и заботы. Необходимо регулярно осуществлять проверку состояния металлических поверхностей, чтобы своевременно обнаружить признаки коррозии и принять меры для ее предотвращения или остановки. Регулярное обслуживание и уход за металлоконструкциями помогут сохранить их долговечность и надежность.
Вопрос-ответ

Что такое коррозия?
Коррозия – это процесс разрушения металлов под воздействием окружающей среды. В результате коррозии на поверхности металла образуется оксид, который может вызывать его дальнейшее разрушение.
Какие вещества могут вызывать коррозию металлов?
Коррозию металлов могут вызывать вещества, которые реагируют с металлом и образуют оксид. Например, воздух, содержащий кислород и влагу, вероятно, вызовет коррозию большинства металлов.
Какие факторы ускоряют процесс коррозии металлов?
Несколько факторов могут ускорить процесс коррозии металлов. Влажность, высокая температура и наличие кислот или солей в окружающей среде могут способствовать скорейшему разрушению металлов.
Можно ли предотвратить коррозию металлов?
Хотя полностью исключить коррозию металлов невозможно, можно принять меры для ее минимизации. Например, использование защитных покрытий, проведение периодической очистки и обслуживания металлических поверхностей, а также контроль окружающей среды и поддержание ее в оптимальном состоянии.
