Диссоциация – это процесс, в результате которого ионы, образующие химическое соединение, разлагаются на отдельные заряженные частицы. При диссоциации некоторых веществ, таких как соли или кислоты, образуются катионы металла, которые являются положительно заряженными ионами.
Катионы металла играют важную роль в химических реакциях и имеют различные свойства. Они обладают большой химической активностью и способностью к образованию соединений с отрицательно заряженными анионами. Кроме того, катионы металла могут вступать во взаимодействие с другими ионами или молекулами, образуя координационные соединения.
Примеры катионов металла, которые образуются при диссоциации веществ, включают ионы натрия (Na+), калия (K+), магния (Mg2+), кальция (Ca2+) и многие другие. Каждый из этих катионов обладает своими уникальными свойствами и может использоваться в различных областях науки и техники.
Катионы металла: что это такое?
Катионы металла представляют собой положительно заряженные ионы металлических элементов. Катионы - это атомы металла, которые потеряли один или несколько электронов, приобретая положительный заряд. Процесс образования катионов называется ионизацией или диссоциацией.
Катионы металла играют важную роль во многих химических реакциях и процессах. Они способны образовывать соединения с отрицательно заряженными анионами, образуя структуры с ионными связями. Как правило, катионы металла имеют свойства, обусловленные их химической природой и структурой.
Катионы металла широко используются в различных отраслях промышленности и научных исследованиях. Они используются в производстве металлов, сплавов, катализаторов, электродов и других материалов. Катионы металла также играют важную роль в живых организмах, где они участвуют в метаболических процессах и поддержании жизнедеятельности.
Катионы металла имеют различные свойства, химическую активность и способность образовывать соединения с другими элементами. Некоторые металлы образуют одновалентные катионы (например, Na+), другие - двухвалентные (например, Cu2+), а некоторые - многовалентные катионы, способные принимать несколько различных зарядов (например, Fe2+ и Fe3+). Катионы металла могут иметь различную степень окисления и способность образовывать комплексы с лигандами.
Важно отметить, что катионы металла играют ключевую роль в электролитических реакциях, ионном обмене и электропроводности. Они также могут быть использованы для определения концентрации металлов в различных образцах и исследовании их химических свойств. Изучение катионов металла имеет большое значение в научных исследованиях и практическом применении в различных областях химии и материаловедения.
Катионы: основные понятия и определения

Катионы - это положительно заряженные ионы, образующиеся при диссоциации некоторых веществ в растворе. Катионы обладают сильными электронными связями с анионами и имеют внутренний электрический заряд, который оказывает влияние на их физические и химические свойства.
Одно из ключевых понятий, связанных с катионами, - это ионизация. Ионизация - это процесс, при котором атом или молекула теряют или получают электроны, образуя положительно или отрицательно заряженные ионы. Когда вещество диссоциирует в растворе, положительные заряды передаются на анионы, тогда как отрицательные заряды передаются на катионы.
Важно отметить, что катионы имеют особую роль в химических реакциях. Они могут служить катализаторами, участвовать в обмене электронами, а также образовывать стабильные соединения с анионами. Кроме того, катионы могут образовывать соли или комплексы с другими веществами, что позволяет им проявлять разнообразные свойства и влиять на реакции и переходы веществ.
Для удобства классификации катионы могут быть разделены на несколько групп в зависимости от исходного вещества или химической природы. Некоторые из распространенных групп катионов включают ионы щелочных металлов (например, Na+, K+), ионы щелочноземельных металлов (например, Mg2+, Ca2+) и ионы переходных металлов (например, Fe2+, Cu2+). Каждая группа катионов имеет свои особенности и свойства, которые делают их уникальными.
В заключение, катионы представляют собой важный класс ионов, имеющих положительный заряд и играющих важную роль в химических реакциях и процессах. Они обладают своими особенностями и свойствами, что позволяет использовать их в различных областях химии, физики и других наук.
Диссоциация веществ: как это происходит?
Диссоциация веществ - это процесс, при котором молекулы вещества разделяются на ионы или атомы. Этот процесс протекает при растворении веществ в воде или при плавлении твердых веществ.
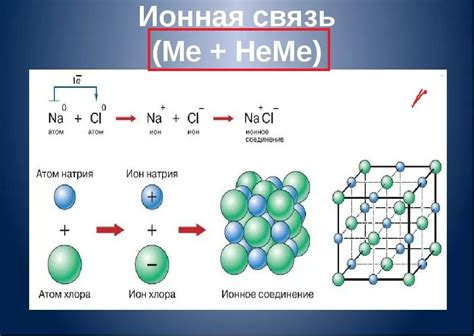
В случае диссоциации катионы металла, такие как Na+, Mg2+, Al3+ и другие, образуются в результате разрыва связей в молекулах вещества. Такие катионы обладают положительным зарядом и способны образовывать соль с отрицательно заряженными анионами.
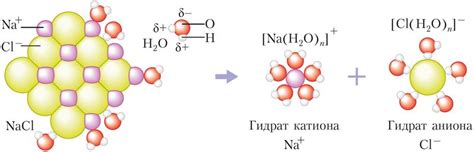
Для примера, рассмотрим диссоциацию хлорида натрия (NaCl). При растворении в воде хлорид натрия разделяется на ионы Na+ и Cl-. Ионы Na+ представляют собой катионы натрия, а ионы Cl- являются анионами хлора. Эти ионы образуют ионную решетку в растворе, которая обеспечивает проводимость данного раствора.
Диссоциация веществ может происходить не только в растворах, но и при плавлении твердых веществ. Например, при плавлении хлорида натрия его молекулы разделяются на ионы, а ионная решетка хлорида натрия становится подвижной.
Процесс диссоциации и его физический смысл

Процесс диссоциации является химической реакцией, при которой молекулы вещества распадаются на ионы при взаимодействии с растворителем или в результате нагревания. Данный процесс особенно характерен для растворов электролитов.
Физический смысл диссоциации заключается в том, что при распаде молекулы на ионы образуется электрически заряженные частицы. Это означает, что ранее нейтральные части молекул приобретают определенный заряд и становятся способными проводить электрический ток.
Одной из основных характеристик диссоциации является степень диссоциации, которая определяет, в какой мере молекулы вещества распадаются на ионы. Степень диссоциации обычно выражается в виде доли или процента.
Процесс диссоциации важен в химии, так как позволяет объяснить многие реакции и свойства веществ. В частности, диссоциация ионных соединений объясняет их способность образовывать растворы, проводить электрический ток, участвовать в различных химических реакциях и обладать определенными свойствами.
Катионы металла при диссоциации: основные примеры

Катионы металла играют ключевую роль в процессе диссоциации некоторых веществ, когда они расщепляются на положительно заряженные ионы и отрицательно заряженные анионы. Различные металлы могут формировать разные катионы при диссоциации, и каждый из них имеет свои уникальные свойства и химические реакции.
Один из наиболее известных катионов металла - это катион натрия (Na+), который образуется при диссоциации солей натрия, например, хлорида натрия (NaCl). Катион натрия играет важную роль в множестве биологических процессов и химических реакций, таких как передача нервных импульсов и регуляция равновесия воды в организме.
Еще один важный катион металла - катион кальция (Ca2+), который образуется при диссоциации солей кальция, таких как хлорид кальция (CaCl2). Катион кальция играет ключевую роль во многих жизненно важных процессах, включая сокращение мышц, передачу нервных импульсов и образование костной ткани.
Также существуют различные катионы металла, такие как катион железа (Fe2+ и Fe3+), катион меди (Cu+ и Cu2+), катион цинка (Zn2+), катион магния (Mg2+) и другие. Каждый из них имеет свои уникальные свойства и реактивность, и они широко используются в промышленности и медицине.
В заключение, знание о катионах металла при диссоциации является важной составляющей в понимании процессов химических реакций и их применения в различных областях науки и промышленности.
Катионы металла в растворе: свойства и характеристики
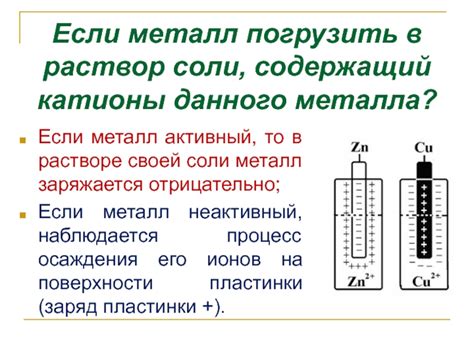
Катионы металла представляют собой положительно заряженные ионы, которые образуются при диссоциации некоторых веществ в растворе. В растворе катионы металла имеют свои особенности и характеристики, которые важны для понимания процессов, происходящих в химических реакциях.
Одним из основных свойств катионов металла является их положительный заряд, который они получают при потере одного или нескольких электронов. Это позволяет им образовывать ионные связи с отрицательно заряженными анионами и другими катионами. Кроме того, катионы металла имеют обычно большую массу и атомный радиус по сравнению с анионами, что влияет на их физические и химические свойства.
Особенностью катионов металла в растворе является их способность образовывать кристаллические решетки и соли. При этом они могут образовывать различные структуры с разными степенями симметрии в зависимости от специфических свойств металла и его взаимодействия с другими компонентами раствора.
Катионы металла также обладают способностью образовывать комплексы с различными лигандами, которые могут быть органическими или неорганическими соединениями. Это позволяет растворяемым катионам металла проявлять свои химические свойства в различных реакциях, таких как окислительно-восстановительные, комплексообразование, гидролиз и др.
В целом, катионы металла в растворе обладают широким спектром свойств и характеристик, которые определяют их роль и влияние в различных химических процессах. Изучение этих свойств позволяет лучше понять особенности растворов и реакций, в которых принимают участие катионы металла.
Роль катионов металла в химических реакциях
Катионы металла играют важную роль в химических реакциях, так как они обладают определенными свойствами, которые влияют на химические процессы. Катионы металла являются ионами положительного заряда, образующимися при диссоциации некоторых веществ в растворе.
Одним из самых распространенных примеров катионов металла являются ионы железа Fe²⁺ и Fe³⁺, которые играют важную роль в множестве биохимических процессов. Например, катионы железа необходимы для образования гемоглобина, который является основным пигментом красных кровяных клеток и обеспечивает транспорт кислорода в организме.
Катионы металла также присутствуют во многих катализаторах, которые активируют химические реакции, ускоряют их прохождение или модифицируют продукты реакции. Например, платиновые катализаторы используются в процессе гидрирования нефти и газа, а также в производстве пластиков и лекарственных препаратов.
Катионы металла также часто участвуют в реакциях обмена и реагируют с отрицательно заряженными анионами, образуя соединения. Например, в реакции между катионами натрия Na⁺ и анионами хлорида Cl⁻ образуется хлорид натрия NaCl, который является одним из самых распространенных солей.
Катионы металла также могут встраиваться в кристаллическую решетку минералов, придавая им специфические свойства. Так, ионы кальция Ca²⁺ играют важную роль в формировании костной ткани, а ионы магния Mg²⁺ участвуют в активации множества ферментных реакций в организме.
Влияние катионов металла на химические процессы
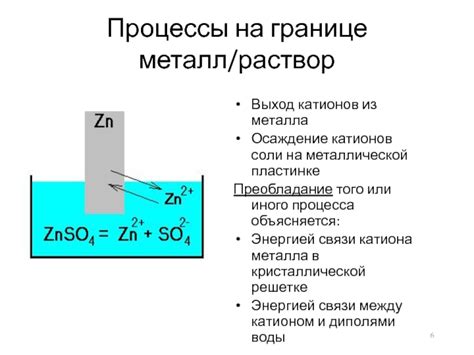
Катионы металла играют важную роль в химических процессах, так как могут взаимодействовать с другими веществами и влиять на их реакцию. Катионы металла могут быть как катализатором, активизирующим реакцию, так и ингибитором, замедляющим ее протекание.
Катионы металла способны встраиваться в структуру молекул, образуя комплексы с органическими и неорганическими соединениями. Это может приводить к изменению их свойств и структуры. Например, катионы металла могут влиять на физико-химические свойства вещества, такие как температура плавления, растворимость, а также на его электрохимическую активность.
Вещества, содержащие в своей структуре катионы металла, могут проявлять различные свойства, которые могут быть использованы в разных отраслях промышленности. Например, некоторые катионы металла обладают антибактериальными свойствами и могут использоваться в медицине для создания противомикробных препаратов.
Важно отметить, что воздействие катионов металла на химические процессы может быть как положительным, так и отрицательным. В некоторых случаях катионы металла могут вызывать разрушительные или токсические эффекты, вредные для организмов и окружающей среды. Поэтому необходимо тщательно изучать влияние катионов металла на химические процессы и их воздействие на окружающую среду, чтобы эффективно использовать их свойства и минимизировать потенциальные негативные последствия.
Связь катионов металла с другими веществами

Катионы металла могут образовывать различные связи с другими веществами, как в реакциях диссоциации, так и в процессе образования соединений с анионами или молекулами других веществ. Эти связи могут быть ионными, ковалентными или координатными в зависимости от химической природы катиона и характера веществ, с которыми он взаимодействует.
Катионы металла, например, могут образовывать ионные связи с анионами, при этом катион превращается в сильное положительное ионное ядро, притягивающее отрицательные анионы. Это позволяет образовывать кристаллические решетки, такие как в соли. Например, катион натрия (Na+) может образовывать ионную связь с анионом хлора (Cl-), образуя соль натрия и хлорида (NaCl).
Катионы также могут образовывать ковалентные связи с другими веществами. В таких связях электроны делятся между атомами, создавая общий электронный облако. Например, катион аммония (NH4+) может образовывать ковалентную связь с анионом гидроксида (OH-), образуя аммоний гидроксид (NH4OH).
Также катионы металла могут образовывать координатные связи с молекулами других веществ, где электронные пары атомов кислорода, азота или серы образуют связь с металлическим катионом. Например, катион железа (Fe2+) может образовать координатную связь с молекулой аммиака (NH3), образуя комплексное соединение Fe(NH3)6^2+.
Таким образом, катионы металла обладают различными свойствами взаимодействия с другими веществами, что позволяет им образовывать разнообразные соединения и участвовать в химических реакциях, в том числе при диссоциации некоторых веществ.
Взаимодействие катионов металла с анионами и молекулами

Катионы металла взаимодействуют с анионами и молекулами, образуя различные соединения. Это взаимодействие происходит благодаря электростатическим силам притяжения между зарядами. Катионы металла, имеющие положительный электрический заряд, притягивают к себе анионы и нейтральные молекулы с отрицательными полюсами.
Взаимодействие катионов металла с анионами происходит за счет обменных реакций, при которых катионы замещают другие катионы или осаждается осадок. В результате таких реакций образуются различные соли, в которых катионы металла соединены с анионами помощи ионных связей.
Взаимодействие катионов металла с молекулами происходит на основе различных химических реакций, таких как координационная или органическая реакция. В координационной реакции катионы металла образуют комплексы с молекулами, донорами электронов, такими как ациды или лиганды.
В органической реакции катионы металла могут служить как катализаторы, активирующие химические связи в органических молекулах. Катионы металла могут присоединяться к двусвязным углеродным атомам и участвовать в реакции с другими молекулами, образуя новые соединения.
Вопрос-ответ

Какие вещества образуют катионы металла при диссоциации?
Вещества, которые образуют катионы металла при диссоциации, называются солями. Сюда относятся, например, хлориды, нитраты, сульфаты и другие соединения.
Как происходит диссоциация веществ?
Диссоциация - это процесс, при котором ионные вещества расщепляются на ионы в растворе. В случае катионов, металлический ион полностью отделяется от молекулярной структуры вещества и образует катион металла.
Какие свойства имеют катионы металла?
Катионы металла имеют положительный заряд и обладают рядом характерных свойств. Они могут притягивать отрицательно заряженные ионы и молекулы, образуя с ними соли. Кроме того, катионы металла могут участвовать в химических реакциях и образовывать различные соединения.
Какие именно металлы образуют катионы при диссоциации?
Катионы металла могут образовываться при диссоциации множества различных металлов. К ним относятся, например, калий, натрий, магний, кальций, железо, алюминий и др. Каждый металл образует свой тип катиона с соответствующими свойствами.
Какие физические и химические свойства характерны для катионов металла?
Катионы металла обычно имеют блестящую поверхность и хорошую электропроводность. Они также способны образовывать соли и принимать участие в различных химических реакциях, образуя новые соединения. Кроме того, катионы металла могут образовывать комплексы с другими соединениями и являться катализаторами реакций.
